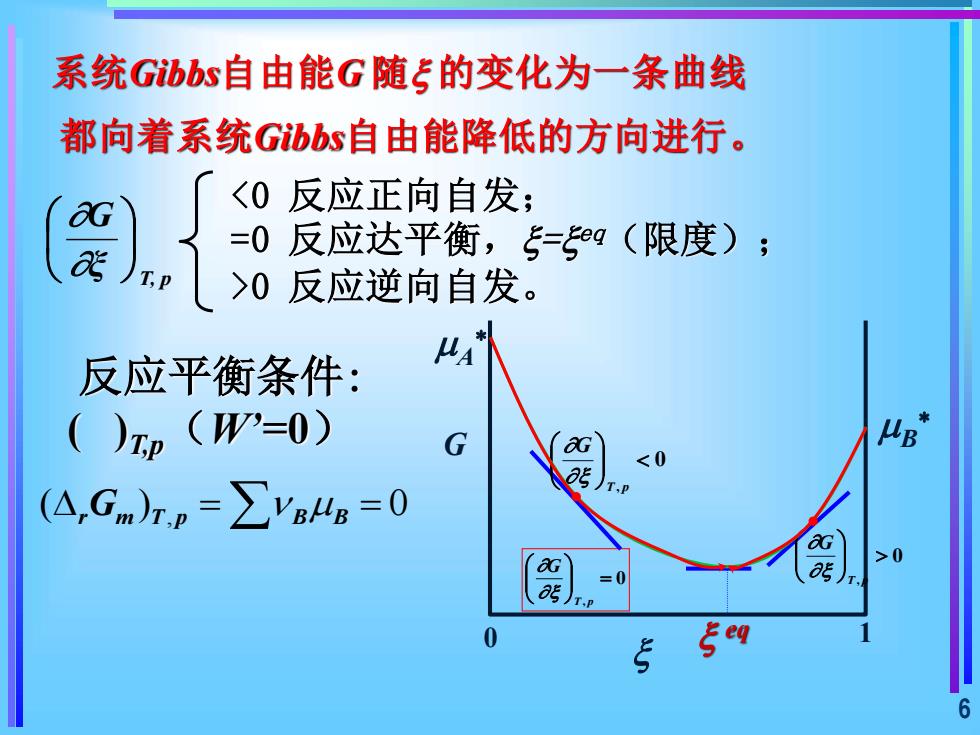
系统Gibbs自由能G随=的变化为一条曲线都向着系统Gibbs自由能降低的方向进行。<0反应正向自发;OG=0反应达平衡,=eq(限度);aTP>0反应逆向自发。美A反应平衡条件:()Tp (W'=0)μBGaG<0aJT.P(A,Gm)r, =ZVBlg =0aG>0aGas0=aseqS6
6 反应平衡条件: ( )T,p(W’=0) T, p ξ G , ( ) 0 = = r m T p B B G 系统Gibbs自由能G 随 的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 <0 反应正向自发; =0 反应达平衡,= eq(限度); >0 反应逆向自发。 G 0 eq 1 A B 0 , T p G 0 , = T p G 0 , T p G

三、化学反应的平衡常数和等温方程假设有理想气体化学反应aA+bB二gG+hH当反应达到平衡gug+hu=aua+bug混合理想气体B的化学势表达式为:PBμp(T,p)= μ(T)+ RT In6D则上式可写为PGgue+gRTIn+hRTIn+hunDaμ% +aRT In+bug+bRT In
7 三、化学反应的平衡常数和等温方程 假设有理想气体化学反应 aA + bB gG + hH 当反应达到平衡 G H A B g h a b + = +B B B ( , ) ( ) ln p T p T RT p = + 混合理想气体B的化学势表达式为: 则上式可写为 ln ln ln ln G H G H A B A B p p g gRT h hRT p p p p a aRT b bRT p p + + + = + + +
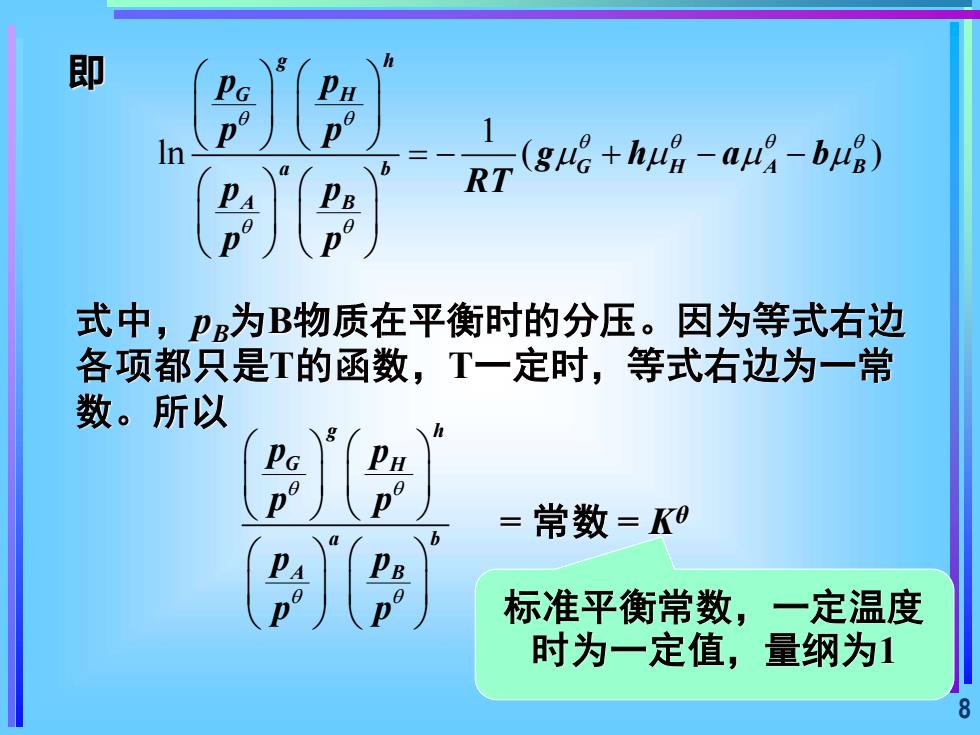
即D(gue+hu-au-bug)InRT()()式中,P为B物质在平衡时的分压。因为等式右边各项都只是T的函数,T一定时,等式右边为一常数。所以= 常数=K020标准平衡常数,一定温度n时为一定值,量纲为1
8 即 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − 式中,pB为B物质在平衡时的分压。因为等式右边 各项都只是T的函数,T一定时,等式右边为一常 数。所以 g h G H a b A B p p p p p p p p = 常数 = Kθ 标准平衡常数,一定温度 时为一定值,量纲为1

DD(gue+hun-aua-bug)InRT()()如果令gu+hu-au%-bug=A,Gm则反应的标准吉布斯函数变化,指反应物和产物均处于标准态时,产物△,G" =-RTlnK0的吉布斯函数与反应物的吉布斯函数总和之差9
9 如果令 1 ln ( ) g h G H a b G H A B A B p p p p g h a b p p RT p p = − + − − G H A B r m g h a b G + − − = 则 ln r m G RT K = − 反应的标准吉布斯函数 变化,指反应物和产物 均处于标准态时,产物 的吉布斯函数与反应物 的吉布斯函数总和之差

若反应在定温定压下进行,其中各分压是任意的而不是平衡态时的分压,则反应系统的吉布斯函数变化为:A,Gm=(guG+hu)-(au+buB)=(gu+hu-au-bug)+RTlr范特霍夫等温方程A,Gm=A,Gm+RT InQ=Qp=-RTInK°+RTInQ10
10 若反应在定温定压下进行,其中各分压是任意的, 而不是平衡态时的分压,则反应系统的吉布斯函数 变化为: ( ) ( ) = + − + r m G H A B G g h a b ' ' ' ' ( ) ln g h G H G H A B a b A B p p p p g h a b RT p p p p = + − − + ln ln ln r m r m p p G G RT Q RT K RT Q = + = − + =Qp 范特霍夫等温方程