
第一节滴定分析原理、滴定分析的基本概念标准溶液(standardsolution)试样(sample)化学计量点(stoichiometricpoint)滴定终点(endpointoftitration)指示剂(indicator)滴定误差(titrationerror)
第一节 滴定分析原理 一、滴定分析的基本概念 标准溶液(standard solution) 试样(sample) 化学计量点(stoichiometric point) 滴定终点(end point of titration) 指示剂(indicator) 滴定误差(titration error)
第一节滴定分析原理pH、计被测定物质已知准确浓度的溶液量表示试样标准溶液计量点滴定Na2CO3+HCI误差滴定终点滴定剂滴定指示剂→颜色变化、NaOH+HCI>NaCI+HO沉淀产生计量点pH=7指示剂酚酥pH:8.0-9.6
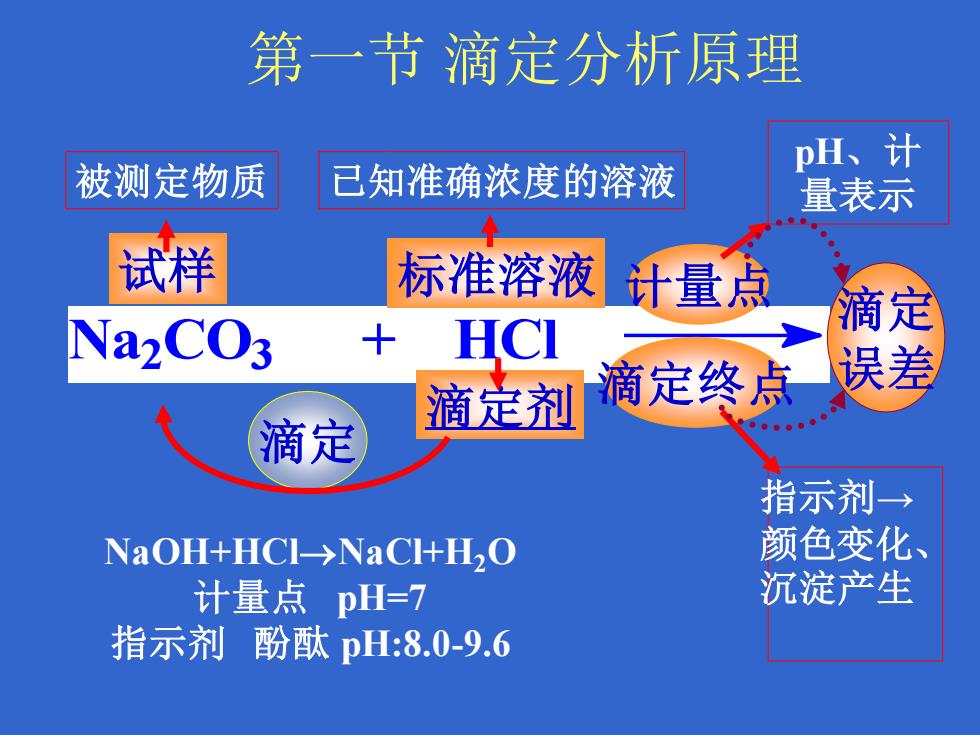
Na2 CO3 + HCl 试样 被测定物质 滴定剂 标准溶液 已知准确浓度的溶液 计量点 pH、计 量表示 指示剂→ 颜色变化、 沉淀产生 滴定 滴定终点 误差 NaOH+HCl→NaCl+H2O 计量点 pH=7 指示剂 酚酞 pH:8.0-9.6 滴定 第一节 滴定分析原理

第一节滴定分析原理一、滴定分析的基本概念(被测定物质)(已知准确浓度的溶液)试样计量点标准溶液HCINa2CO3+滴定误差滴定剂滴定终点指示剂NaOH+HCI→NaCI+HO滴定误差计量点pH=7指示剂酚pH:8.0-9.6
第一节 滴定分析原理 一、滴定分析的基本概念 (被测定物质) (已知准确浓度的溶液) 试样 标准溶液 计量点 Na2CO3 + HCl 滴定误差 滴定剂 滴定终点 指示剂 NaOH + HCl → NaCl + H2O 滴定误差 计量点 pH=7 指示剂 酚酞 pH:8.0-9.6

第一节滴定分析原理二、滴定分析反应的条件和要求。反应必须按化学计量关系完成,而且进行完全(要求达到99.9%以上)。,反应必须迅速完成。对于速率较慢的反应,有时可通过加热或加催化剂等方法来加速·无副反应发生或可采取适当方法消除副反应必须有比较简便可靠的方法确定滴定终点
第一节 滴定分析原理 二、滴定分析反应的条件和要求 反应必须按化学计量关系完成,而且进行完全 (要求达到99.9﹪以上)。 反应必须迅速完成。对于速率较慢的反应,有时 可通过加热或加催化剂等方法来加速。 无副反应发生或可采取适当方法消除副反应。 必须有比较简便可靠的方法确定滴定终点

第一节滴定分析原理三、滴定分析的类型和一般过程1.按滴定方式分类有以下四种方法直接滴定返滴定法间接滴定法置换滴定法
第一节 滴定分析原理 三、滴定分析的类型和一般过程 1. 按滴定方式分类有以下四种方法: 直接滴定 返滴定法 间接滴定法 置换滴定法