
5.2氧化还原反应的速率 5.2.1浓度的影响 c增加,反应速率增大(质量作用定律) 5.2.2温度的影响 温度每增高10°℃,反应速率增大2-3倍. 例:KMnO4滴定H2C204,需加热至70-80℃. 16
16 5.2 氧化还原反应的速率 5.2.1 浓度的影响 c增加, 反应速率增大(质量作用定律) 5.2.2 温度的影响 温度每增高10℃, 反应速率增大2-3倍. 例: KMnO4滴定H2C2O4 ,需加热至70-80℃

5.2.3催化剂与反应速率 p:1.44V 例1.Ce4+氧化AsD的反应分两步: 0.56V AsD慢As(IV快As(Y K'=1030 加入少量K1,可加快反应速度 例2. 2Mn04+5C2042-+16H+=2Mn2++10C02+8H20 开始时反应慢,随着Mn(仙)的产生,反应越来越快. 自动催化反应: 由于生成物本身引起催化作用的反应
17 加入少量KI,可加快反应速度 5.2.3 催化剂与反应速率 : 1.44V, 0.56V K = 10 As(III) As(IV) As(V) 慢 快 30 例1.Ce4+氧化As(III)的反应分两步: 2MnO4 - + 5C2O4 2- +16H+ = 2Mn2+ + 10CO2 + 8H2O 开始时反应慢,随着Mn(II)的产生,反应越来越快. 自动催化反应: 由于生成物本身引起催化作用的反应。 例2
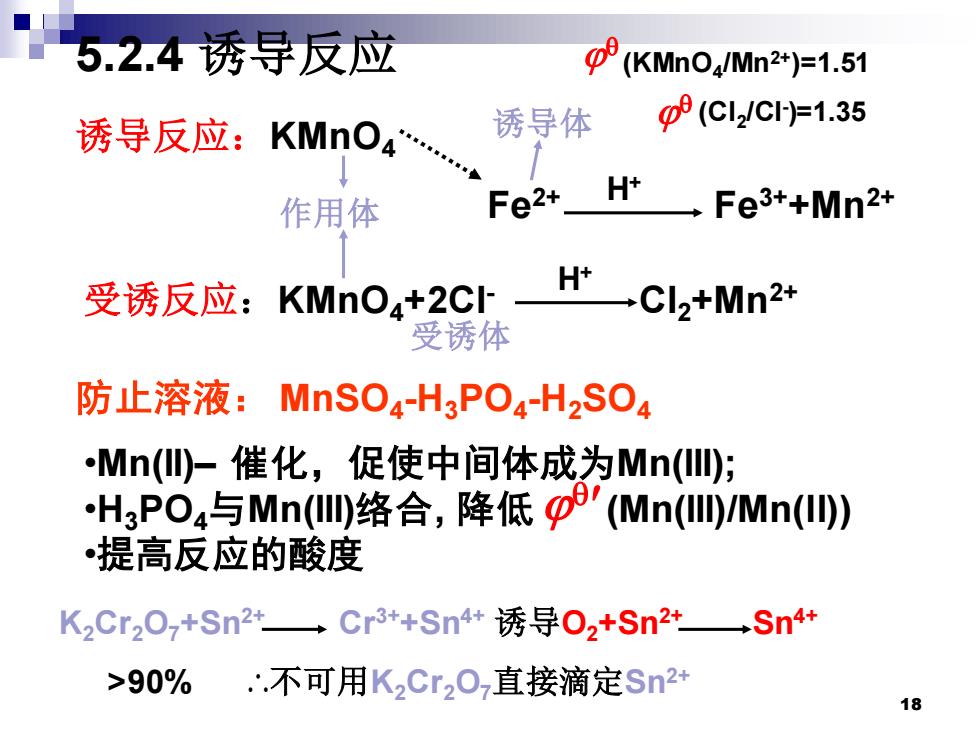
5.2.4诱导反应 (KMnO4/Mn2+)=1.51 诱导反应:KMnO4 诱导体 03(Cl2C片1.35 Fe2+ H+ 作用体 一Fe3+Mn2+ 受诱反应:KMnO4+2 CIHCI2tMn2* 受诱体 防止溶液:MnSO4-H3PO4-H2SO4 Mn(仙-催化,促使中间体成为Mn(ll); H3PO4与Mn(l络合,降低p'(Mn(l/Mn() •提高反应的酸度 K2Cr20,+Sn24Cr3+Sn4+诱导02tSn2tSn4+ >90% ∴不可用K2Cr20,直接滴定Sn2+ 18
18 5.2.4 诱导反应 防止溶液: MnSO4 -H3PO4 -H2SO4 诱导反应:KMnO4 Fe2+ Fe3++Mn2+ 受诱反应:KMnO4+2Cl- Cl2+Mn2+ H+ H+ 诱导体 作用体 受诱体 •Mn(II)– 催化,促使中间体成为Mn(III); •H3PO4与Mn(III)络合, 降低 (Mn(III)/Mn(II)) •提高反应的酸度 K2Cr2O7+Sn2+ Cr3++Sn4+ 诱导O2+Sn2+ Sn4+ >90% ∴不可用K2Cr2O7直接滴定Sn2+ (KMnO4 /Mn2+)=1.51 (Cl2 /Cl- )=1.35

5.3氧化还原滴定 5.3.1氧化还原滴定中的指示剂 1.自身指示剂:KMnO4 2×10-6mo小L1即可见粉红色 2.特殊指示剂 例:淀粉+2(1×105moL1) 生成深蓝色吸附化合物, SCN+Fe3+一FeSCN2+ (1×10-5moL1可见红色) 19
19 5.3 氧化还原滴定 5.3.1 氧化还原滴定中的指示剂 1. 自身指示剂: KMnO4 2×10-6mol·L-1即可见粉红色 2. 特殊指示剂 例:淀粉 + I2 (1 ×10-5mol·L-1 ) 生成深蓝色吸附化合物, SCN + Fe3+ FeSCN2+ ( 1 ×10-5mol·L-1可见红色)
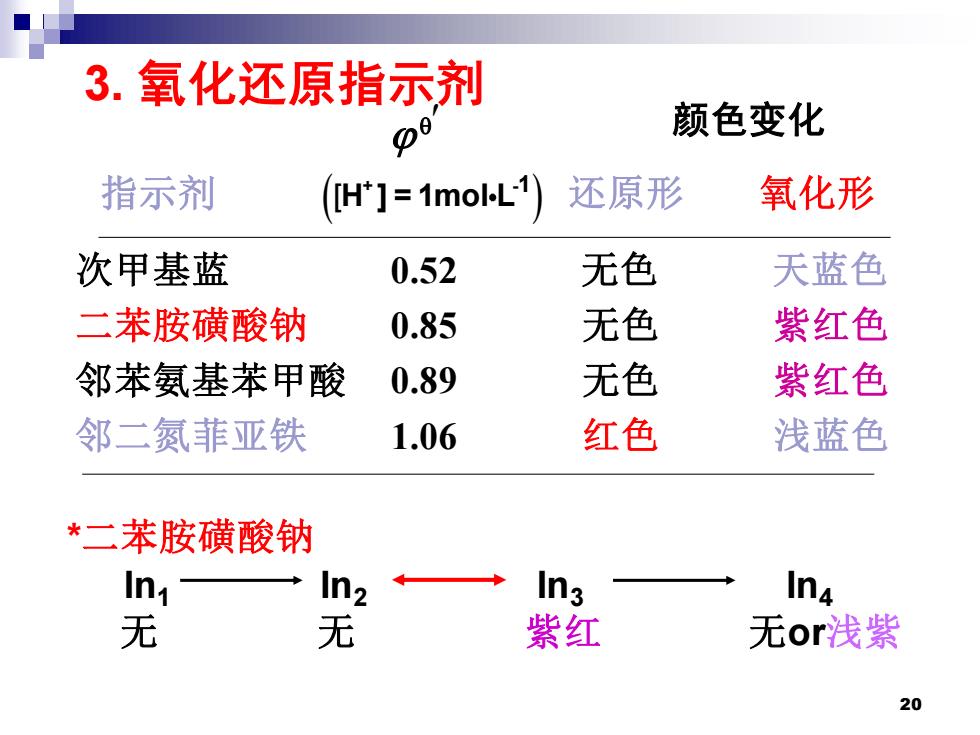
3.氧化还原指示剂 po 颜色变化 指示剂 (H]=1moL) 还原形 氧化形 次甲基蓝 0.52 无色 天蓝色 二苯胺磺酸钠 0.85 无色 紫红色 邻苯氨基苯甲酸 0.89 无色 紫红色 邻二氮菲亚铁 1.06 红色 浅蓝色 *二苯胺磺酸钠 Ini In2 In In4 无 无 紫红 无or浅紫 20
20 3. 氧化还原指示剂 指示剂 还原形 氧化形 颜色变化 ( ) + -1 H ] = 1mol L [ 次甲基蓝 0.52 无色 天蓝色 二苯胺磺酸钠 0.85 无色 紫红色 邻苯氨基苯甲酸 0.89 无色 紫红色 邻二氮菲亚铁 1.06 红色 浅蓝色 In1 In2 In3 In4 无 无 紫红 无or浅紫 *二苯胺磺酸钠