
导航 4.实验过程。 用0.1000moL1NaOH溶液滴定20.00mL浓度约为0.1 moL1HC溶液。 (1)滴定管中装入 标准溶液),锥形瓶中盛放 (待测溶液,预先滴有几滴酸碱指示剂,如
导航 4.实验过程。 用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL浓度约为0.1 mol·L-1 HCl溶液。 (1)滴定管中装入 NaOH溶液 (标准溶液),锥形瓶中盛放 HCl溶液 (待测溶液,预先滴有几滴酸碱指示剂,如 酚酞或 甲基橙 )
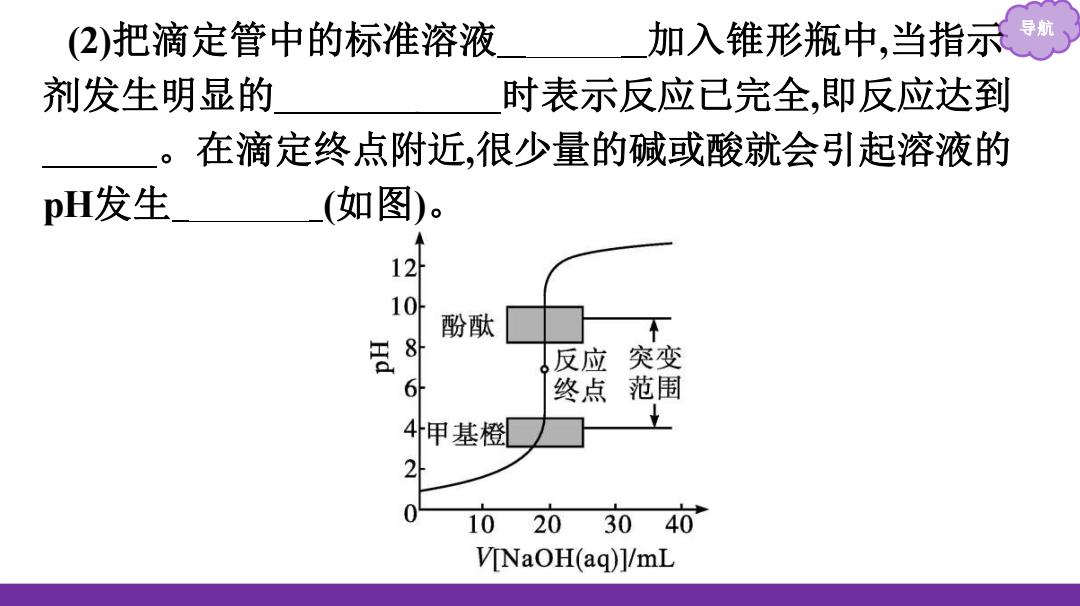
(2)把滴定管中的标准溶液 加入锥形瓶中,当指示 剂发生明显的 时表示反应已完全,即反应达到 在滴定终点附近,很少量的碱或酸就会引起溶液的 pH发生 (如图)。 12 酚酞 反应 突变 6 终点 范围 4甲基橙 2 1020 3040 V[NaOH(aq)]/mL
导航 (2)把滴定管中的标准溶液 逐滴 加入锥形瓶中,当指示 剂发生明显的 颜色变化 时表示反应已完全,即反应达到 终点 。在滴定终点附近,很少量的碱或酸就会引起溶液的 pH发生 突变 (如图)

导期 5.数据处理。 6.中和滴定误差分析方法。 以用NaOH标准溶液滴定未知浓度的盐酸为例,分析误差要 根据计算式c待一V标分析:当用标准溶液滴定待测溶液时,c、 V待均为 值,c的大小取决于 的大小,V标偏大,则结 果 ;V标 ,则结果偏低
导航 5.数据处理。 6.中和滴定误差分析方法。 以用 NaOH 标准溶液滴定未知浓度的盐酸为例,分析误差要 根据计算式 c 待 = 𝒄 标·𝑽标 𝑽待 分析:当用标准溶液滴定待测溶液时,c 标、 V 待均为 定 值,c 待的大小取决于 V 标 的大小,V 标偏大,则结 果 偏高 ; V 标 偏小 ,则结果偏低
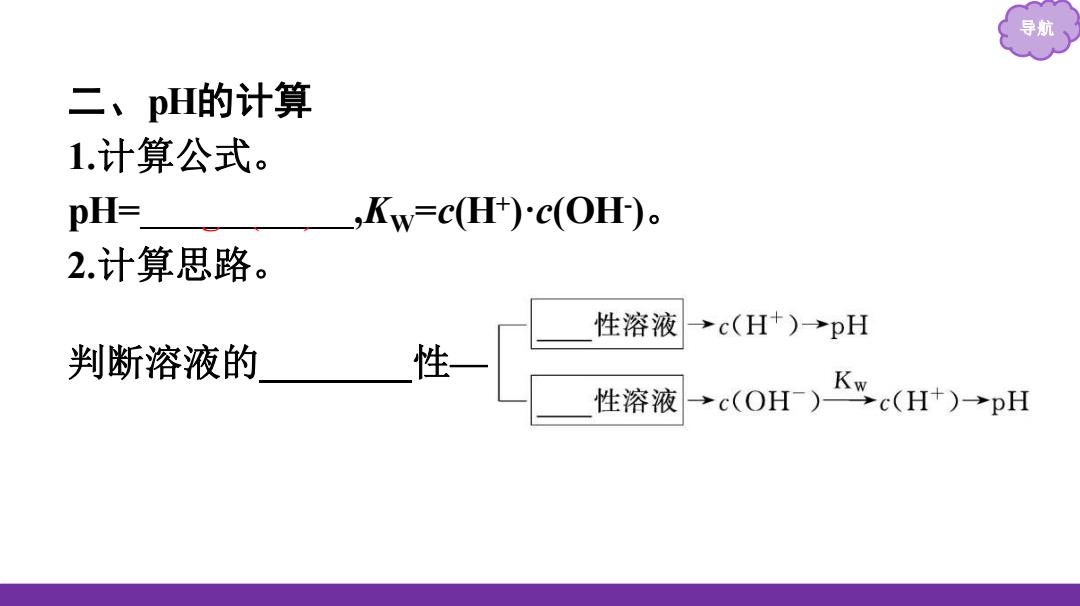
导航 二、pH的计算 1.计算公式。 pH= ,Kw=CH)c(OH)。 2.计算思路。 性溶液 →c(H+)→pH 判断溶液的 性 性溶液 →c(OH)Kc(H*)pH
导航 二、pH的计算 1.计算公式。 pH= -lg c(H + ) , KW = c(H + )· c(OH - ) 。 2.计算思路。 判断溶液的 酸碱 性—

导航 微思考1mLpH=5的稀盐酸加水稀释至1000mL后溶液的 pH=8,对吗? 提示:不对。酸无限稀释后仍然呈酸性,即室温下溶液的H 无限接近于7,但仍小于7,所以在计算时要考虑水电离提供的 Ht
导航 微思考1 mL pH=5的稀盐酸加水稀释至1 000 mL后溶液的 pH=8,对吗? 提示:不对。酸无限稀释后仍然呈酸性,即室温下溶液的pH 无限接近于7,但仍小于7,所以在计算时要考虑水电离提供的 H+