
A、HAsO4一-HAsO:B、NH3-NHE C、HCO;-CO3 D、H2S-—S0 ()10.下列两溶液等体积混合后,具有缓冲能力的一组是: A、0.lmol·LHCl和0.lmol·LNaAc B、0.1mol·L'HC1和0.2mol·LNaAc C、0.2mol·L'HCl和0.2mol·L NaOH D、0.2mol·LHC1和0.1mol·LNaAc ()11.pH值为5.00的H2SO4溶液用水稀释1000倍后,溶液的pH值为: A、6.00B、接近7.00C、7.00D、8.00 ()12.难溶电解质AB2的沉淀溶解反应为AB2(s)=A2+(aq)汁2B(aq)当 达到平衡时,难溶物AB2的溶解度S与溶度积Ksp的关系是: A、S=V2KpB、S=HKpC、S=gKmD、S=Kp ()13.下列试剂中能使BaSO4(s)溶解度增大的是: A、BaCl2 B、Na2SO4C、Hz0 D、KNO3 ()14.下列叙述正确的是: A、分子间力HF>HC>HB>HB、相对分子质量愈大,分子间力愈大 C、键有极性分子一定有极性D、I2和CC14分子间只存在色散力 ()15.下列分子为非极性分子的是: A、BF3B、CHCI3C、HO D、NH ()16.下列描述核外电子运动状态的四个量子数(n,1,m,ms)不合理 的一组是: A、(2、1、-1、+) B、(3、0、-1、-) C、(4、3、2、+) D、(3、1、0、-克) ()17.具有下列电子构型的原子,第一电离势最小的为: A、[Ar]3dIo4SIB、[Ar]3d54SC、Nel]3SID、[Ar4S ()18.下列晶体物质熔点的判断正确的是:
A、H3AsO4 ——H2AsO − 4 B、NH3——NH − 2 C、HCO − 3 ——CO 2− 3 D、H2S——SO 2− 4 ( )10.下列两溶液等体积混合后,具有缓冲能力的一组是: A、0.1mol·L -1HCl 和 0.1mol·L -1NaAc B、0.1mol·L -1HCl 和 0.2mol·L -1NaAc C、0.2mol·L -1HCl 和 0.2mol·L -1NaOH D、0.2mol·L -1HCl 和 0.1mol·L -1NaAc ( )11.pH 值为 5.00 的 H2SO4 溶液用水稀释 1000 倍后,溶液的 pH 值为: A、6.00 B、接近 7.00 C、7.00 D、8.00 ( )12.难溶电解质 AB2的沉淀溶解反应为 AB2(s)==A2+(aq)+2B- (aq) 当 达到平衡时,难溶物 AB2 的溶解度 S 与溶度积 Ksp的关系是: A、S= 2Ksp B、S= 3 4 1 Ksp C、S= 2 Ksp 1 D、S= 4 4Ksp ( )13.下列试剂中能使 BaSO4(s)溶解度增大的是: A、BaCl2 B、Na2SO4 C、H2O D、KNO3 ( )14.下列叙述正确的是: A、分子间力 HF>HCl>HBr>HI B、相对分子质量愈大,分子间力愈大 C、键有极性分子一定有极性 D、I2 和 CCl4 分子间只存在色散力 ( )15.下列分子为非极性分子的是: A、BF3 B、CHCl3 C、H2O D、NH3 ( )16.下列描述核外电子运动状态的四个量子数(n,l,m,ms)不合理 的一组是: A、(2、1、-1、+ 2 1 ) B、(3、0、-1、- 2 1 ) C、(4、3、-2、+ 2 1 ) D、(3、1、0、- 2 1 ) ( )17.具有下列电子构型的原子,第一电离势最小的为: A、[Ar]3d104S1 B、[Ar]3d54S1 C、[Ne]3S1 D、[Ar]4S1 ( )18.下列晶体物质熔点的判断正确的是:

A、SiO2>H2O>CO2>NaF B、SiO2>CO2>HO>NaF C、SiO2>NaF>C02>H20 D、SiO2>NaF>H2O>C02 ()19.下列物质间不能形成分子间氢键的是: A、HF一H2O B、HO-H2O C、NH3-H2O D、CH4-H2O ()20.根据价层电子对互斥理论X©F4的空间构型是: A、八面体B、四面体C、平面正方形D、平面六边形 二、填空(30分) 1.将32.0g02(M=32.0gmol')和42.0gN2M=28.0gmo')混合于10.0dm 的容器中,27℃时混合物的总压力为 _kPa,O2的分压为」 kPa, N2的分压为 2.有四个反应,在298K时反应的热力学数据分别为 反应 1 2 3 4 ArHm°/kJ·molP 10.5 1.80 -126 -120 4rSmo/J·mor·K 30.0 -113 84.0 -150 则在标准状态下,任何温度都能自发进行的反应是 :任何温度都不能自 发进行的反应是:当T≥350K时反应可以自发进行:当T≤800K 时反应可以自发进行。 3.己知反应N2(gr3H(g==2NH3(g)4rHm°=-92.6kJ·mo。升高 温度,正反应速度,化学平衡 移动,平衡常数 :加 入催化剂正反应速度,化学平衡 移动。 4.已知反应Ag一B+C当A的浓度c1=0.2mol·L1时,反应速度为 v1:c2=0.1molL1时,反应速度为2。当2w1=1.0时反应级数为:当21=0.5 时反应级数为:当21=0.25时反应级数为 5.在BaSO4饱和溶液中,加入NaSO4溶液,则BaSO4的溶解度 原因是 ,而加入NH4NO3溶液后BaSO4的溶解度。 6.己知某元素的原子序数比氪小,当它失去三个电子后,=2的轨道内电
A、SiO2> H2O>CO2> NaF B、SiO2>CO2>H2O> NaF C、SiO2> NaF >CO2>H2O D、SiO2> NaF > H2O>CO2 ( )19.下列物质间不能形成分子间氢键的是: A、HF—H2O B、H2O—H2O C、NH3—H2O D、CH4—H2O ( )20.根据价层电子对互斥理论 XeF4 的空间构型是: A、八面体 B、四面体 C、平面正方形 D、平面六边形 二、填空(30 分) 1.将 32.0g O2(M=32.0g·mol-1 )和 42.0g N2(M=28.0g·mol-1 )混合于 10.0dm-3 的容器中,27℃时混合物的总压力为 kPa,O2 的分压为 kPa, N2的分压为 kPa。 2.有四个反应,在 298K 时反应的热力学数据分别为 反应 1 2 3 4 ΔrHm o / kJ·mol-1 10.5 1.80 -126 -120 ΔrSm o / J·mol-1 ·K -1 30.0 -113 84.0 -150 则在标准状态下,任何温度都能自发进行的反应是 ;任何温度都不能自 发进行的反应是 ;当 T≥350K 时反应 可以自发进行;当 T≤800K 时反应 可以自发进行。 3.已知反应 N2(g)+3H2(g)====2NH3(g) ΔrHm o = -92.6 kJ·mol-1。升高 温度,正反应速度 ,化学平衡 移动,平衡常数 ;加 入催化剂正反应速度 ,化学平衡 移动。 4.已知反应 A (g)—→B + C 当 A 的浓度 c1=0.2mol·L -1 时,反应速度为 v1;c2=0.1mol·L -1 时,反应速度为 v2。当 v2/v1=1.0 时反应级数为 ;当 v2/v1=0.5 时反应级数为 ;当 v2/v1=0.25 时反应级数为 。 5.在 BaSO4 饱和溶液中,加入 Na2SO4 溶液,则 BaSO4 的溶解度 , 原因是 ,而加入 NH4NO3 溶液后 BaSO4的溶解度 。 6.已知某元素的原子序数比氪小,当它失去三个电子后,l=2 的轨道内电
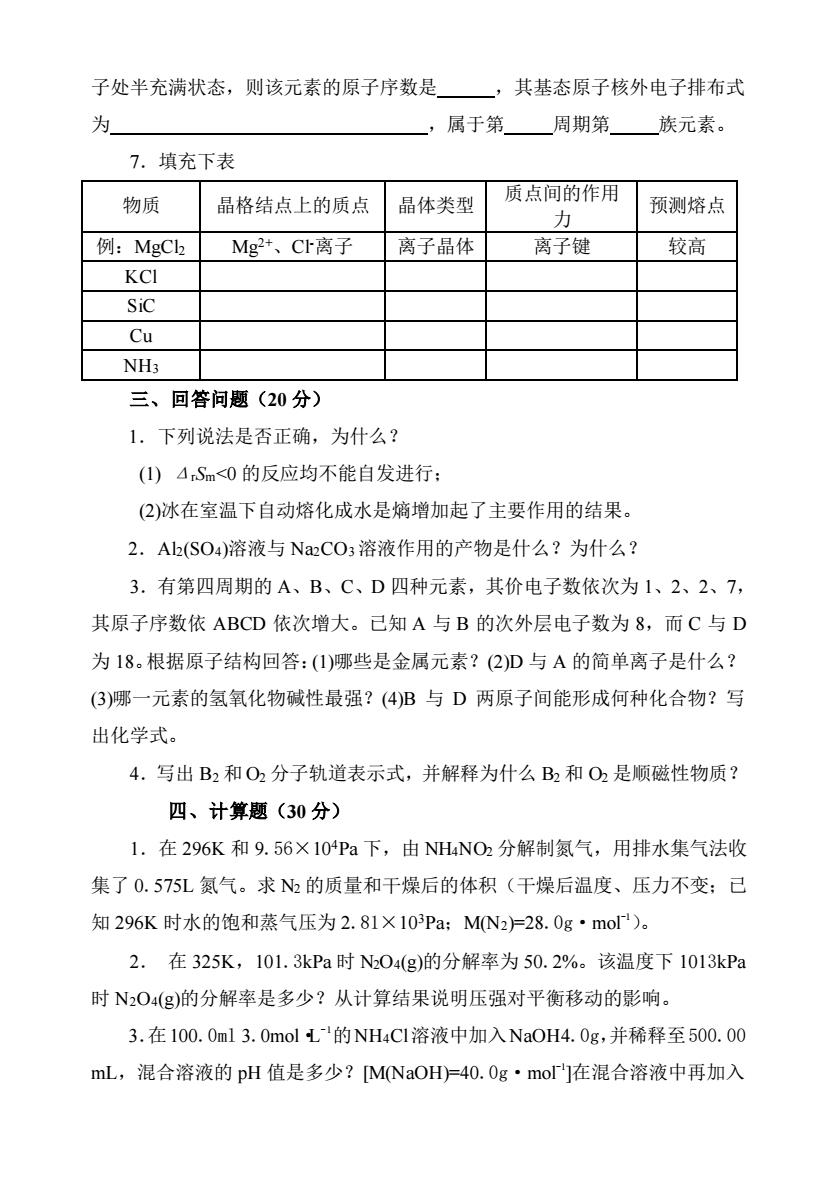
子处半充满状态,则该元素的原子序数是 ,其基态原子核外电子排布式 为 ,属于第周期第族元素。 7.填充下表 物质 晶格结点上的质点 晶体类型 质点间的作用 预测熔点 力 例:MgCh Mg2+、CI离子 离子晶体 离子键 较高 KCI SiC Cu 三、回答问题(20分) 1.下列说法是否正确,为什么? (1)ASm<0的反应均不能自发进行: (2)冰在室温下自动熔化成水是熵增加起了主要作用的结果。 2.Alb(SO4)溶液与NaCO3溶液作用的产物是什么?为什么? 3.有第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7, 其原子序数依ABCD依次增大。已知A与B的次外层电子数为8,而C与D 为18。根据原子结构回答:(1)哪些是金属元素?(2)D与A的简单离子是什么? (3)哪一元素的氢氧化物碱性最强?(4)B与D两原子间能形成何种化合物?写 出化学式。 4.写出B2和O2分子轨道表示式,并解释为什么B2和O2是顺磁性物质? 四、计算题(30分) 1.在296K和9.56×104Pa下,由NH4NO2分解制氮气,用排水集气法收 集了0.575L氮气。求的质量和干燥后的体积(干燥后温度、压力不变:己 知296K时水的饱和蒸气压为2.81×10Pa:MN2=28.0g·mo)。 2.在325K,101.3kPa时N04(g)的分解率为50.2%。该温度下1013kPa 时N204(g)的分解率是多少?从计算结果说明压强对平衡移动的影响。 3.在100.0ml3.0molL的NH4C1溶液中加入NaOH4.0g,并稀释至500.00 mL,混合溶液的pH值是多少?[M(NaOH)=40.0g·molr]在混合溶液中再加入
子处半充满状态,则该元素的原子序数是 ,其基态原子核外电子排布式 为 ,属于第 周期第 族元素。 7.填充下表 物质 晶格结点上的质点 晶体类型 质点间的作用 力 预测熔点 例:MgCl2 Mg2+、Cl-离子 离子晶体 离子键 较高 KCl SiC Cu NH3 三、回答问题(20 分) 1.下列说法是否正确,为什么? (1) ΔrSm<0 的反应均不能自发进行; (2)冰在室温下自动熔化成水是熵增加起了主要作用的结果。 2.Al2(SO4)溶液与 Na2CO3溶液作用的产物是什么?为什么? 3.有第四周期的 A、B、C、D 四种元素,其价电子数依次为 1、2、2、7, 其原子序数依 ABCD 依次增大。已知 A 与 B 的次外层电子数为 8,而 C 与 D 为 18。根据原子结构回答:(1)哪些是金属元素?(2)D 与 A 的简单离子是什么? (3)哪一元素的氢氧化物碱性最强?(4)B 与 D 两原子间能形成何种化合物?写 出化学式。 4.写出 B2 和 O2 分子轨道表示式,并解释为什么 B2 和 O2 是顺磁性物质? 四、计算题(30 分) 1.在 296K 和 9.56×104Pa 下,由 NH4NO2 分解制氮气,用排水集气法收 集了 0.575L 氮气。求 N2 的质量和干燥后的体积(干燥后温度、压力不变;已 知 296K 时水的饱和蒸气压为 2.81×103Pa;M(N2)=28.0g·mol-1)。 2. 在 325K,101.3kPa 时 N2O4(g)的分解率为 50.2%。该温度下 1013kPa 时 N2O4(g)的分解率是多少?从计算结果说明压强对平衡移动的影响。 3.在100.0ml 3.0mol·L - 1的NH4Cl溶液中加入NaOH4.0g,并稀释至500.00 mL,混合溶液的 pH 值是多少?[M(NaOH)=40.0g·mol-1 ]在混合溶液中再加入

1.0ml0.5mol·L NaOH,溶液的pH值又是多少? (KNH31.78X10 4.己知反应S(单斜)+02(g)一=S02(g)4P=-297.09kJ·mo, S(正交)+02(g)=S02(g)4=-296.80kJ·mo;Sa(单斜硫)F32.6 J·mo·K,S(正交硫)上31.8J·mo·K。计算说明在标准状态下,当温 度为298K和390K时,硫的哪种品型更稳定?两种品型的转变温度是多少?
1.0 ml 0.5 mol·L -1 NaOH,溶液的 pH 值又是多少? (Kb(NH3)= 1.78×10-5 ) 4.已知反应 S(单斜) + O2(g)=== SO2(g) ΔrHo =-297.09kJ·mol-1, S(正交) + O2(g)=== SO2(g) ΔrHo =-296.80kJ·mol-1 ;S m (单斜硫)= 32.6 J·mol-1·K -1,S m (正交硫)= 31.8 J·mol-1·K -1。计算说明在标准状态下,当温 度为 298K 和 390K 时,硫的哪种晶型更稳定?两种晶型的转变温度是多少?