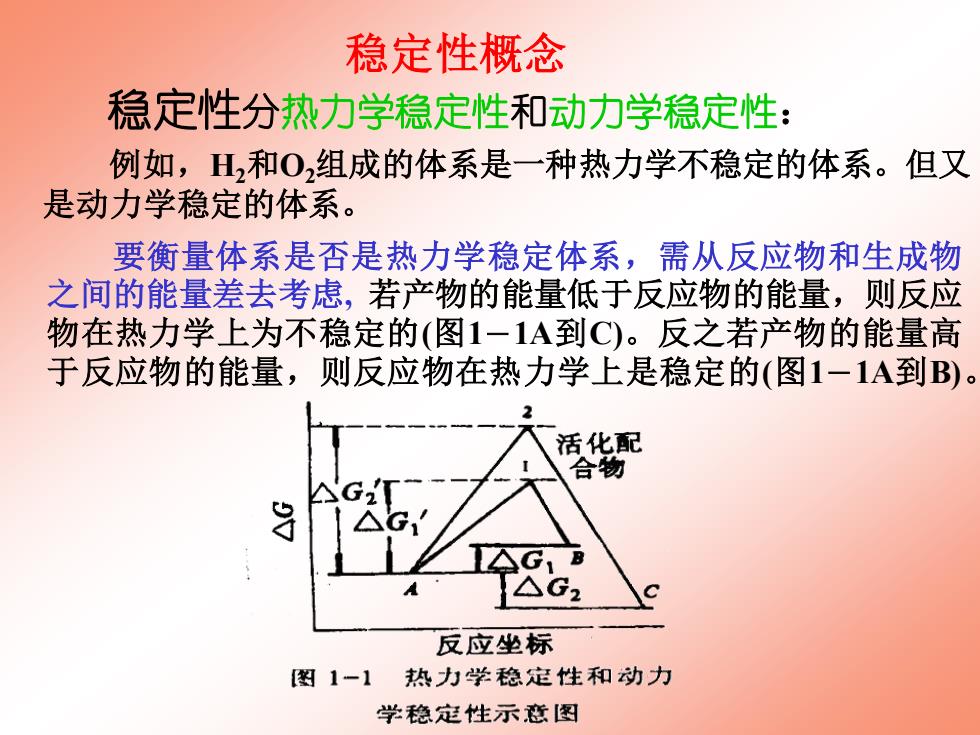
稳定性概念 稳定性分热力学稳定性和动力学稳定性: 例如,H,和0,组成的体系是一种热力学不稳定的体系。但又 是动力学稳定的体系。 要衡量体系是否是热力学稳定体系,需从反应物和生成物 之间的能量差去考虑,若产物的能量低于反应物的能量,则反应 物在热力学上为不稳定的(图1一1A到C)。反之若产物的能量高 于反应物的能量,则反应物在热力学上是稳定的(图1一1A到B)。 活化配 合物 J1 B △G2 反应坐标 图1-1热力学稳定性和动力 学稳定性示意图
稳定性分热力学稳定性和动力学稳定性: 例如,H2和O2组成的体系是一种热力学不稳定的体系。但又 是动力学稳定的体系。 稳定性概念 要衡量体系是否是热力学稳定体系,需从反应物和生成物 之间的能量差去考虑, 若产物的能量低于反应物的能量,则反应 物在热力学上为不稳定的(图1-1A到C)。反之若产物的能量高 于反应物的能量,则反应物在热力学上是稳定的(图1-1A到B)

动力学稳定性是从反应物与活化配合物之间的能量差,即反 应活化能来考虑的,若某一反应物转变为产物的趋势很大,反应 物在热力学上相当不稳定,但若实现这一反应所需的活化能也相 当大的话,则在动力学上反应物又是相当稳定的了(图1一2A到C)。 活化配 合物 AG2还G 反应坐标 图1一2由动力学控制的热 力学不稳定体系 热力学稳定性和动力学稳定性之间没有必然的联系。 催化剂可以改变反应的历程,亦即能改变反应的活化能,因此,催化 剂可以增加或降低动力学稳定性,但催化剂不能改变热力学的稳定性或 不稳定性
热力学稳定性和动力学稳定性之间没有必然的联系。 催化剂可以改变反应的历程,亦即能改变反应的活化能,因此,催化 剂可以增加或降低动力学稳定性,但催化剂不能改变热力学的稳定性或 不稳定性。 动力学稳定性是从反应物与活化配合物之间的能量差,即反 应活化能来考虑的,若某一反应物转变为产物的趋势很大,反应 物在热力学上相当不稳定,但若实现这一反应所需的活化能也相 当大的话, 则在动力学上反应物又是相当稳定的了(图1-2A到C)

5.2离子键形成中的能量 5.2.1 气相离子键形成中的能量 对于反应 Na(g)十Cl(g)一Na+(g)+CI-(g)的能量, Ea 由于反应前后熵改变甚微,△G≈△H,所以, △G≈△H≈lNa)+Ea(C) =495.7+(-348.65) =147.05 kJ-mol-1 说明上述反应的趋势很小
5.2 离子键形成中的能量 5.2.1 气相离子键形成中的能量 由于反应前后熵改变甚微,△G≈△H ,所以, △G≈△H ≈I(Na)+Ea(Cl) =495.7+(-348.65) =147.05 kJmol-1 说明上述反应的趋势很小。 对于反应 Na(g)+Cl(g) Na+(g)+Cl-(g) 的能量, Ea I

带相反电荷的两个离子,可因静电吸引而结合在一起,该 引力为: U2=-9+9 另一方面,两个离子趋近时,因电子层的穿插而导致强排斥力: U3=be-r/p 所以由Na(g)和CI(g)形成Na+CI一(g)离子对时,总能量为: 8=147.05+U2+Ug=147.05-949+ber/p
带相反电荷的两个离子,可因静电吸引而结合在一起,该 引力为: U2=- r q q+ − 另一方面,两个离子趋近时,因电子层的穿插而导致强排斥力: U3=be-r/ρ 所以由Na(g)和Cl(g)形成Na+Cl-(g)离子对时,总能量为: ε=147.05+U2+U3=147.05- +be-r / ρ r q q+ −
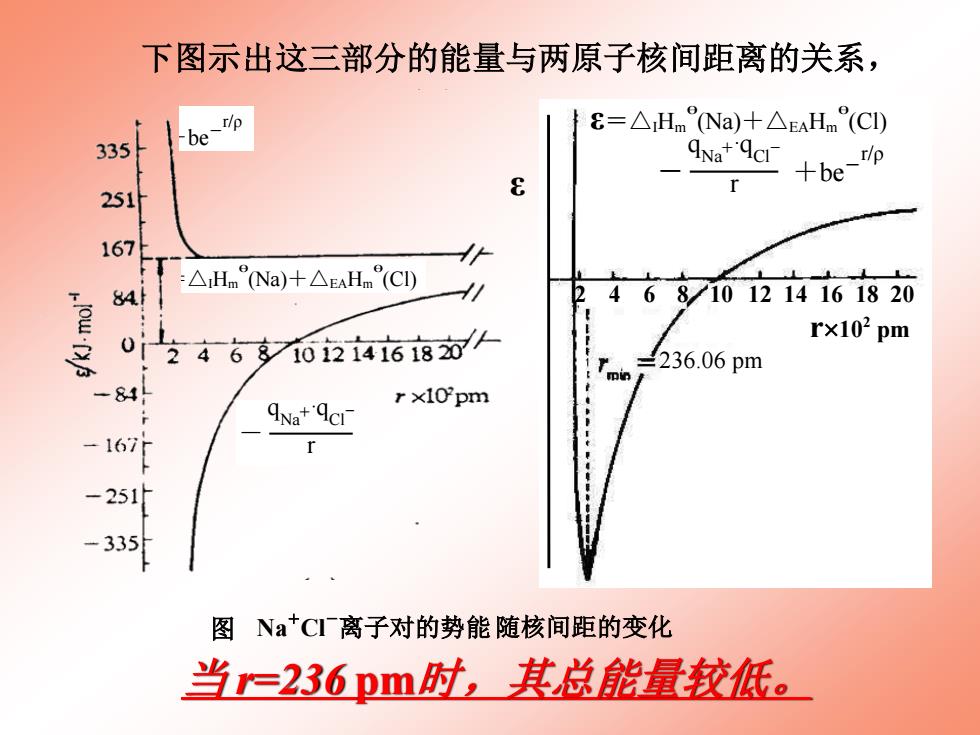
下图示出这三部分的能量与两原子核间距离的关系, be- E=△HmNa)十△EaHm(CI) 335 ANa+'qcI- r +be-p 251 e 167 :△Hm°Na)+△EAHm(CI) 84 24687101214161820 r×102pm 24 6多o2i468茹仆 236.06pm -84 r x1Opm ANat'Acr 16 -251 -335 图Na+CI离子对的势能随核间距的变化 当=236pm时,其总能量校低
当 r=236 pm时,其总能量较低。 下图示出这三部分的能量与两原子核间距离的关系, ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na+ Cl- 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na+ Cl- 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na+ Cl- 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na+ Cl- 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·q Cl - r 图 5.8 Na + Cl - 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na+ Cl- 离子对的势能 随核间距的变化 ε 236.06 pm 2 4 6 8 10 12 14 16 18 20 r102 pm ε=△IHm θ (Na)+△EAHm θ (Cl) - +be- r/ρ q Na +·qCl- r 图 5.8 Na + Cl- 离子对的势能 随核间距的变化