
实验一高氯酸标准溶液(0.1mo1/L)的配制与标定
实验一 高氯酸标准溶液(0.1 mol/L)的配制与标定

1.目的要求掌握非水溶液酸碱滴定的原理及操作。熟悉微量滴定管的使用方法。了解高氯酸标准溶液的配制方法及注意事项
1.目的要求 掌握非水溶液酸碱滴定的原理及操作。 熟悉微量滴定管的使用方法。 了解高氯酸标准溶液的配制方法及注意事项

2.原理在冰醋酸中,高氯酸的酸性最强。因此在非水滴定中常采用高氯酸作滴定剂,以高氯酸的冰醋酸溶液为滴定液的标准溶液高氯酸、冰醋酸均含有水分,需加入计算量的醋酐,以除去其中的水分
2.原理 • 在冰醋酸中,高氯酸的酸性最强。因此在 非水滴定中常采用高氯酸作滴定剂,以高 氯酸的冰醋酸溶液为滴定液的标准溶液。 高氯酸、冰醋酸均含有水分,需加入计算 量的醋酐,以除去其中的水分
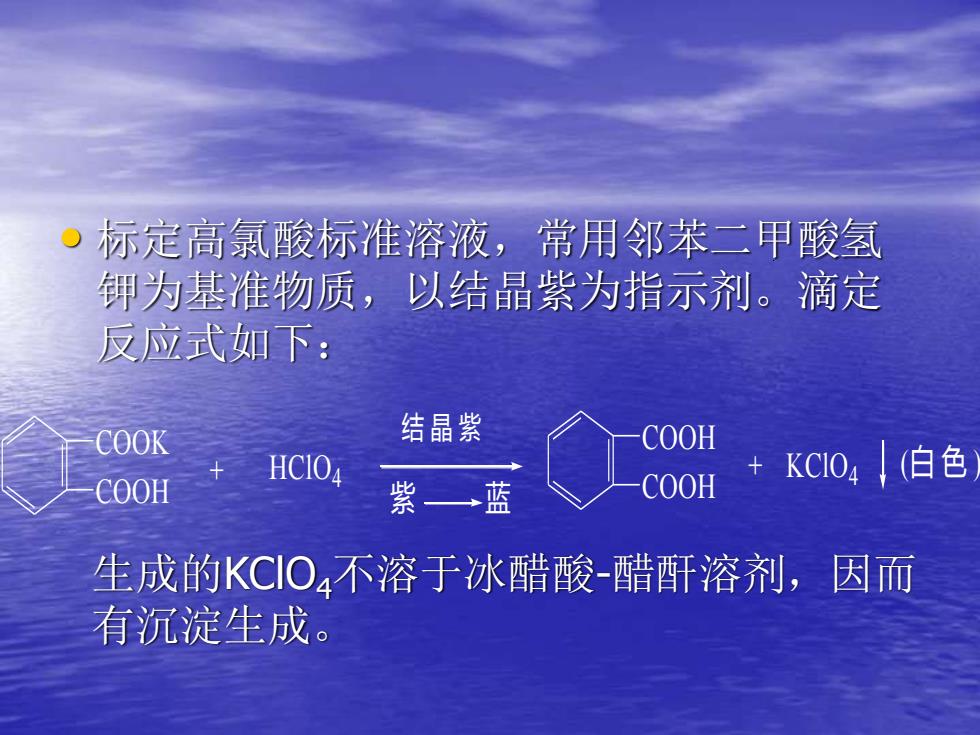
标定高氯酸标准溶液,常用邻苯二甲酸氢钾为基准物质,以结晶紫为指示剂。滴定反应式如下:结晶紫COOHCOOK+KCIO4/(白色HCIO4COOHCOOH紫蓝生成的KCIO4不溶于冰醋酸-醋酐溶剂,因而有沉淀生成
• 标定高氯酸标准溶液,常用邻苯二甲酸氢 钾为基准物质,以结晶紫为指示剂。滴定 反应式如下: COOK COOH + HClO4 结 晶 紫 紫 蓝 COOH COOH + KClO4 (白 色 ) 生成的KClO4不溶于冰醋酸-醋酐溶剂,因而 有沉淀生成

·HCIO4标准溶液的浓度按下式计算:WKHC,H,o, (g)CHCIOAMKHC,H.04VHCIO,×福1000MkHC,H,o, =204.2(g/mol)·式中,为空白校正后的体积
• HClO4标准溶液的浓度按下式计算: 8 4 4 4 8 4 4 4 8 4 4 KHC H O HClO KHC H O HClO KHC H O W (g) C M V 1000 M 204.2(g / mol) = = •式中,为空白校正后的体积