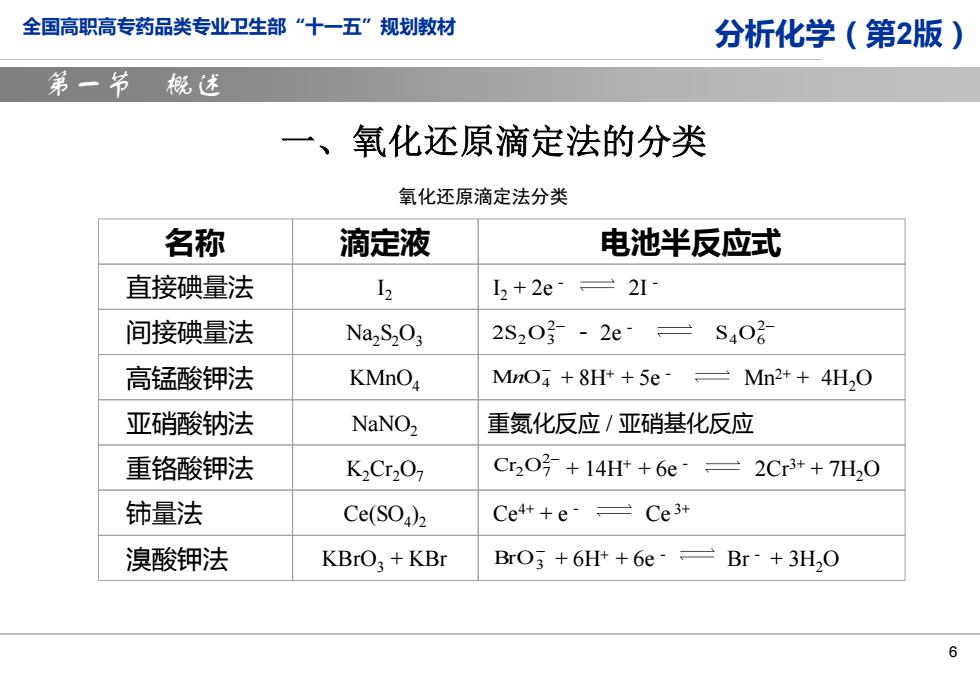
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 第一节概述 →、 氧化还原滴定法的分类 氧化还原滴定法分类 名称 滴定液 电池半反应式 直接碘量法 2 2+2e=2I 间接碘量法 Na,S2O3 2S203-2e S402 高锰酸钾法 KMnO MnO +8H++5e Mn2++4H,O 亚硝酸钠法 NaNO, 重氨化反应/亚硝基化反应 重铬酸钾法 K2Cr2O7 Cr2O3+14Ht+6e°=2Cr3++7H20 铈量法 Ce(SO)2 Ce4++e Ce3+ 溴酸钾法 KBrO:+KBr BrO3 +6H++6e Br +3H,O 6
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 6 第一节 概述 一、氧化还原滴定法的分类 2− 2S2 O3 2− S4 O6 − MnO4 名称 滴定液 电池半反应式 直接碘量法 I2 I2 + 2e- 2I- 间接碘量法 Na2S2O3 - 2e- 高锰酸钾法 KMnO4 + 8H+ + 5e- Mn2+ + 4H2O 亚硝酸钠法 NaNO2 重氮化反应 / 亚硝基化反应 重铬酸钾法 K2Cr2O7 + 14H+ + 6e- 2Cr3+ + 7H2O 铈量法 Ce(SO4 )2 Ce4+ + e- Ce 3+ 溴酸钾法 KBrO3 + KBr + 6H+ + 6e- Br- + 3H2O 2− Cr2 O7 − BrO3 氧化还原滴定法分类

全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 第一节 概述 二、提高氧化还原反应速率的方法 (一)氧化还原反应的主要特点 1.反应机制复杂 2.反应速率较慢 3.伴有副反应,反应条件不同可能生成不同产物 (二)加快氧化还原反应速率的方法 1.增大反应物的浓度或降低生成物的浓度 2.升高溶液的温度(对性质不稳定的物质此方法不 适宜) 3.使用催化剂 7
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 7 第一节 概述 二、提高氧化还原反应速率的方法 (一)氧化还原反应的主要特点 1.反应机制复杂 2.反应速率较慢 3.伴有副反应,反应条件不同可能生成不同产物 (二)加快氧化还原反应速率的方法 1.增大反应物的浓度或降低生成物的浓度 2.升高溶液的温度(对性质不稳定的物质此方法不 适宜) 3.使用催化剂

全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 第一节概述 得堂互动 用高艋酸卿法测定双氧水的含量是否可 以通过加热的方法提高反应速度,为什 6? 8
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 8 课堂互动 用高锰酸钾法测定双氧水的含量是否可 以通过加热的方法提高反应速度,为什 么? 第一节 概述

全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 第一节 概述 三、氧化还原反应进行的程度 (一)能斯特方程式和条件电极电位 1.能斯特方程式 在非标准状态下;对一个可逆的氧化还原电对的 半反应及电极电位可表示为: Ox ne Red 0.0592 POx/Red POx/Red+ aox n ared
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 9 第一节 概述 三、氧化还原反应进行的程度 (一)能斯特方程式和条件电极电位 1.能斯特方程式 在非标准状态下;对一个可逆的氧化还原电对的 半反应及电极电位可表示为: Ox + ne- Red Red Ox Ox/Red Ox/Red lg n 0.0592 a a = +

全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 第一节概述 2.条件电极电位 ·实际工作中,通常知道的是反应物的分析浓度并 非活度,而且不能忽略在溶液体系中可能存在的 副反应。已知活度等于平衡浓度与活度系数的乘 积,而平衡浓度又等于副反应系数与分析浓度的 乘积,即上式可表示为: 10
全国高职高专药品类专业卫生部“十一五”规划教材 分析化学(第2版) 10 实际工作中,通常知道的是反应物的分析浓度并 非活度,而且不能忽略在溶液体系中可能存在的 副反应。已知活度等于平衡浓度与活度系数的乘 积,而平衡浓度又等于副反应系数与分析浓度的 乘积,即上式可表示为: 2.条件电极电位 第一节 概述