
■能自发进行的反应才具有能量,即△G<0的反 应; ■可利用的最大化学能等于△G的数值: 电功(非体积功)Wmax=一△G. ■【 电池反应一般是一氧化还原反应: Zn+Cu2+(aq)Zn2+(aq)+Cu 标态下,298K时△rG=△fGzn2+-△fGcu2+ =-147.06-65.249=-212.31kJ.mo1
◼ 能自发进行的反应才具有能量,即ΔG<0的反 应; ◼ 可利用的最大化学能等于ΔG的数值: 电功(非体积功)Wmax=-ΔG. ◼ 电池反应一般是一氧化还原反应: Zn+ Cu2+(aq)←→Zn2+(aq)+ Cu 标态下,298K时ΔrGø= ΔfGø Zn2+- ΔfGø Cu2+ =-147.06-65.249=-212.31kJ.mol-1

2.电池反应和电极反应 al 电池反应一般是一氧化还原反应 Zn+Cu2+(aq)Zn2+(aq)+Cu 分为两个半反应:氧化半反应Zn→Zn2+(aq)+2e 还原半反应Cu2+(aq)+2e→Cu ■电池负极(一)输出电子,即失电子的反应 (-)Zn→Zn2+(aq)+2e ■电池正极(+)得到电子的反应 (+)Cu2+(aq)+2e→Cu 两个电极反应相加就是电池反应
2.电池反应和电极反应 ◼ 电池反应一般是一氧化还原反应 Zn+ Cu2+(aq)←→Zn2+(aq)+ Cu 分为两个半反应:氧化半反应Zn →Zn2+(aq)+2e 还原半反应Cu2+(aq) +2e→ Cu ◼ 电池负极(-)输出电子,即失电子的反应 (-) Zn →Zn2+(aq)+2e ◼ 电池正极(+)得到电子的反应 (+) Cu2+(aq) +2e→ Cu 两个电极反应相加就是电池反应

注意电极反应就是半反应,有关某个元 素的得或失电子的反应;同样需要配平。 ■Mn04-→Mn2+ Mn04-+5e→Mn2+ MnO+8H++5e Mn2++4H2O 配平要注意:酸性介质H+一H20, 碱性介质用OH一H,O
◼ 注意电极反应就是半反应,有关某个元 素的得或失电子的反应;同样需要配平。 ◼ MnO4 -→ Mn2+ ? MnO4 -+5e → Mn2+ MnO4 -+8H++5e = Mn2++4H2O 配平要注意:酸性介质H+-H2O, 碱性介质用OH--H2O
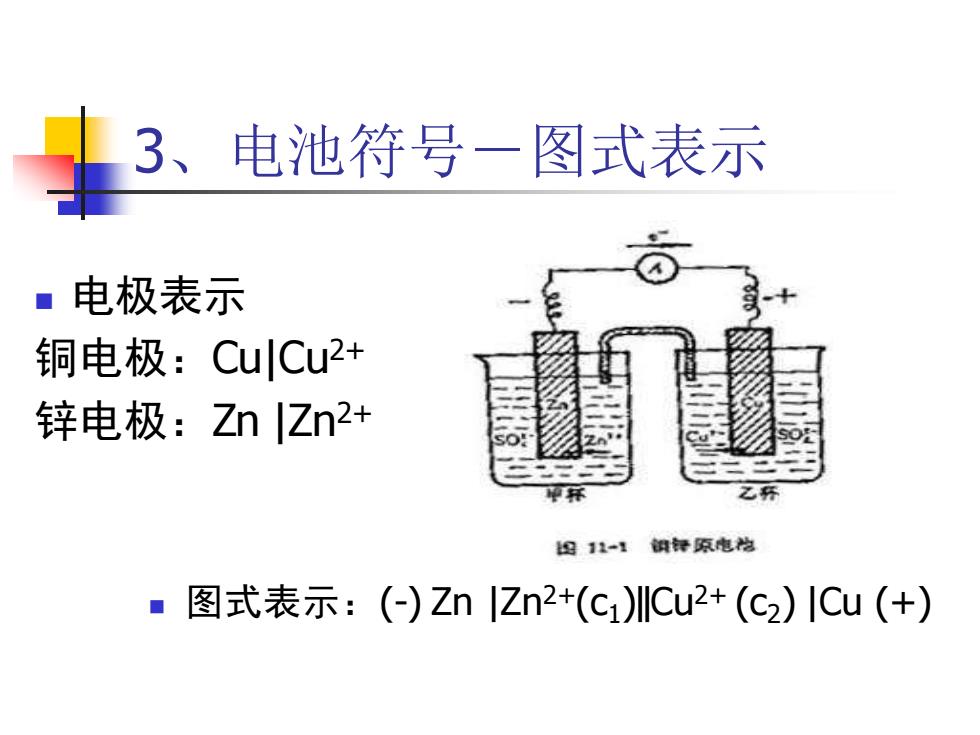
3、电池符号一图式表示 ■电极表示 铜电极:CuCu2+ 锌电极:Zn|Zn2+ 母11-1细钟原电悦 ■图式表示:(-)ZnZn2+(c1)Cu2+(c2)ICu(+)
3、电池符号-图式表示 ◼ 电极表示 铜电极:Cu|Cu2+ 锌电极:Zn |Zn2+ ◼ 图式表示:(-) Zn |Zn2+(c1 )‖Cu2+ (c2 ) |Cu (+)

几种不同电极的表示 氧化态还原态均为溶液:Fe3++e-=Fe2+ 要加惰性电极,如Pt,c等:PtFe2+,Fe3+ ■有气体参与反应:2H十+2e=H2 也要加惰性电极:(Pt)H2H(C) ·有沉淀参与反应:AgC+e=Ag+C Ag|AgCl,Cl(c)
◼ 氧化态还原态均为溶液:Fe3+ + e- =Fe2+ 要加惰性电极,如Pt,C等:Pt |Fe2+ , Fe3+ ◼ 有气体参与反应:2H++2e=H2 也要加惰性电极: (Pt) H2 |H+ (c) 几种不同电极的表示 ◼ 有沉淀参与反应:AgCl+ e=Ag+ Cl- Ag|AgCl,Cl-(c)