
化合物-是由两种或两种以上不同的化学元素的原子组成的。又可分 为:简单化合物:由一种阳离子和一种阴离子组成。NaC1、PbS 单盐化合物:由一种阳离子和一种络阴离子组成。Ca[CO3] 复化合物(复盐):由两种以上阳离子与同种(络)阴离子组成。 CuFeS:2、CaMg[Co3]. 矿物的化学成分无论是单质还是化合物,通常都在一定的范围内有所 变化。变化的原因:有类质同象代替、吸附作用、非化学计量等 通常所说的某种矿物成分中含有某些混入物,除了因类质同像代 替和吸附而存在的成分外,还包括以显微包裹体形式存在的机械混入 物。 三、胶体矿物的成分 1.胶体矿物的概念:胶体是一种物质的微粒(1-100nm)分 散在另一种物质之中,所形成的不均匀的细盼散系。前者称为分散相 (或分散质),后者称为分散媒(或分散介质。 无论是固体、液体或气体,都可以是分散相,也可以是分散媒。按 照分散系统中分散相和分散媒的量比关系,将胶体作如下划分: 1)胶溶体分散相的量远少于分散媒的胶体系统。分散相的质点呈 悬浮状态存在于分散媒中。 2)胶凝体分散相的量远多于分散媒的胶体系统,整个胶体呈凝固 态。 胶体矿物中微粒的排列和分布是不规则和不均匀的,外形上不能
48 化合物-是由两种或两种以上不同的化学元素的原子组成的。又可分 为:简单化合物:由一种阳离子和一种阴离子组成。 NaCl、PbS 单盐化合物:由一种阳离子和一种络阴离子组成。Ca[CO3] 复化合物(复盐):由两种以上阳离子与同种(络)阴离子组成。 CuFeS2、CaMg[CO3]。 矿物的化学成分无论是单质还是化合物,通常都在一定的范围内有所 变化。变化的原因:有类质同象代替、吸附作用、 非化学计量等 通常所说的某种矿物成分中含有某些混入物,除了因类质同象代 替和吸附而存在的成分外,还包括以显微包裹体形式存在的机械混入 物。 三、胶体矿物的成分 1. 胶体矿物的概念:胶体是一种物质的微粒(1-100nm)分 散在另一种物质之中,所形成的不均匀的细分散系。前者称为分散相 (或分散质),后者称为分散媒(或分散介质)。 无论是固体、液体或气体,都可以是分散相,也可以是分散媒。按 照分散系统中分散相和分散媒的量比关系,将胶体作如下划分: 1)胶溶体 分散相的量远少于分散媒的胶体系统。分散相的质点呈 悬浮状态存在于分散媒中。 2)胶凝体 分散相的量远多于分散媒的胶体系统,整个胶体呈凝固 态。 胶体矿物中微粒的排列和分布是不规则和不均匀的,外形上不能

形成规侧的几何多面体,在光学性质上具非晶质体特点,故通常将胶 体矿物看成非晶质矿物。但它的微粒可以是结晶的,因粒径太小,是 一种超显微的晶质(如粘土矿物6 2、胶体的基本性质 (1)胶体质点带有电荷:胶核表面电荷不饱和。可以吸附介质中的 某种离子,在胶核外面形成吸附层,构成带电胶粒。胶粒还要吸附介 质中其它离子团,形成扩散层。可将胶体分为正胶体和负胶体. (2)胶体吸附具有选择性:胶粒在仅能吸附与胶粒电荷相反的某些 离子,而对其它物质则不吸附或吸附程度很小。胶体对一些离子吸附 的难易程度不同,可导致吸附离子之间的交换。通常,阳离子电价越 高,置换能力越强,难被置换;在电价相等时,置换能力随离子半径 增大而增强 金属阳离子置换能力按下列顺序递减: H>AI >Ba >Sr >Ca >Mg >NH4 >K>Na >Li (3)胶体具有巨大表面能:表面边界上原子力场的对称性破坏,出现 剩余键力,即表面能。胶体有从无序向有序过渡,最后形成结晶相的 趋势。表现为胶体微粒的凝聚,分散相与分散媒分离,即脱水作用。 3.胶体矿物的形成:地壳中的水胶凝体矿物,绝大部分都形成于表 生作用中,表生作用中形成的胶体矿物,大体上经历了两个阶段: 1)形成胶体溶液:原生矿物分解物饱和聚集,形成胶体溶液,它是 形成胶体矿物的物质基础。 2)胶体溶液的凝聚:胶体溶液在迁移过程中或汇聚于水盆地后,或
49 形成规则的几何多面体,在光学性质上具非晶质体特点,故通常将胶 体矿物看成非晶质矿物。但它的微粒可以是结晶的,因粒径太小,是 一种超显微的晶质(如粘土矿物 )。 2、胶体的基本性质 (1) 胶体质点带有电荷:胶核表面电荷不饱和。可以吸附介质中的 某种离子,在胶核外面形成吸附层,构成带电胶粒。胶粒还要吸附介 质中其它离子团,形成扩散层。可将胶体分为正胶体和负胶体。 (2) 胶体吸附具有选择性:胶粒在仅能吸附与胶粒电荷相反的某些 离子,而对其它物质则不吸附或吸附程度很小。胶体对一些离子吸附 的难易程度不同,可导致吸附离子之间的交换。通常,阳离子电价越 高,置换能力越强,难被置换;在电价相等时,置换能力随离子半径 增大而增强。 金属阳离子置换能力按下列顺序递减: H >Al >Ba >Sr >Ca >Mg >NH4 >K >Na >Li (3) 胶体具有巨大表面能:表面边界上原子力场的对称性破坏,出现 剩余键力,即表面能。胶体有从无序向有序过渡,最后形成结晶相的 趋势。表现为胶体微粒的凝聚,分散相与分散媒分离,即脱水作用。 3.胶体矿物的形成: 地壳中的水胶凝体矿物,绝大部分都形成于表 生作用中,表生作用中形成的胶体矿物,大体上经历了两个阶段: 1)形成胶体溶液:原生矿物分解物饱和聚集,形成胶体溶液,它是 形成胶体矿物的物质基础。 2)胶体溶液的凝聚:胶体溶液在迁移过程中或汇聚于水盆地后,或

因不同电荷质点发生电性中和而沉淀,或因水分蒸发而凝聚,从而形 成洛种胶体矿物。 四、矿物中的水:根据矿物中水的存在形式以及它们在晶体结构中 的作用,分为两类:不参加晶格,与矿物晶体结构无关的吸附水。参 加晶格或与矿物晶体结构密切相关的,包括结晶水、沸石水、层间水 和结构水。 1、吸附水:不参加晶格,为矿物颗粒或裂隙表面机械吸附的水分子, 可以呈气态、液态或固态,不属于矿物的化学成分,不写入化学式。 常压下,在100一110℃时,吸附水就会全部从矿物中逸出而不破 坏晶格。 2、结晶水:以水分子存在于矿物中,在晶格中具有固定的位置,起 着构造单位的作用,是矿物成分的一部分。水分子数量与矿物的其它 成分之间常成简单比例。结晶水与晶格联系的牢固程度不同失水时, 晶体的结构遭到破坏和重建,形成新的结构。 3、沸石水:存在于沸石族矿物结构的空洞及孔道中的水分子。位置 不固定,含量随温度和湿度而变化。在80-400C范围内,水即大 量逸出,但不起晶格的破坏,只起物理性质的变化。脱水后的沸 石还可以重新吸水,并恢复原有的物理性质。沸石水属于过渡类型的 水。 4、层间水:存在于某些层状结构硅酸盐的结构层之间联结成层的水 分子。加热至110℃时,层间水大量逸出,结构层间距相应缩小, 晶胞轴长C值减小,在潮湿环境中又可重新吸水。属于过渡类型的
50 因不同电荷质点发生电性中和而沉淀,或因水分蒸发而凝聚,从而形 成各种胶体矿物。 四、矿物中的水: 根据矿物中水的存在形式以及它们在晶体结构中 的作用,分为两类:不参加晶格,与矿物晶体结构无关的吸附水。参 加晶格或与矿物晶体结构密切相关的,包括结晶水、沸石水、层间水 和结构水。 1、吸附水:不参加晶格,为矿物颗粒或裂隙表面机械吸附的水分子, 可以呈气态、液态或固态,不属于矿物的化学成分,不写入化学式。 常压下,在 100—110 ℃时,吸附水就会全部从矿物中逸出而不破 坏晶格。 2、结晶水: 以水分子存在于矿物中,在晶格中具有固定的位置,起 着构造单位的作用,是矿物成分的一部分。水分子数量与矿物的其它 成分之间常成简单比例。结晶水与晶格联系的牢固程度不同,失水时, 晶体的结构遭到破坏和重建,形成新的结构。 3、沸石水: 存在于沸石族矿物结构的空洞及孔道中的水分子。位置 不固定,含量随温度和湿度而变化。在 80-400℃范围内,水即大 量逸出,但不引起晶格的破坏,只引起物理性质的变化。脱水后的沸 石还可以重新吸水,并恢复原有的物理性质。沸石水属于过渡类型的 水。 4、层间水:存在于某些层状结构硅酸盐的结构层之间联结成层的水 分子。加热至 110 ℃时,层间水大量逸出,结构层间距相应缩小, 晶胞轴长 C 值减小,在潮湿环境中又可重新吸水。属于过渡类型的

水。 5、结构水:又称化合水。是以(OH)H+、(HO+)离子形试参 加矿物晶格的“水“。结构水在晶格中占有一定位置,在组成上具有 确定的含量比。由于与其它质点有较强的键力联系,需要较高的温度 (大约在600-1000℃)才能逸出。当其逸出后,结构完全破坏, 晶体结构重新改组。 五、矿物的晶体化学式 晶体化学式(或结构式)既可表明矿物中各组分的种类,又能阪 映矿物中原子的结合情况。其书写方法如下: 1)阳离子写在先,复盐中阳离子按碱性强弱排列, 2)阴离子写在后,络阴离子用方括号[]括起。 3)附加阴离子写在主要阴离子或格阴离子的后面 4)含水化合物的水分子写在最后,并用“”与其它组分分开。当含 水量不定时,用nH20或aq(aquq一含水的缩写)表示。SiO2aq或 Ca[S04]2H20. 5)互为类质同象代替的离子用圆括号()括起来,它们中间以” 分开,含量较多的元素般写在前面。Ca(Mg,Fe,Mn)[C03]2- 铁白云石。 计算步骤与实例:计算橄榄石(Mg,Fe)2[SiO4的晶体化学式: 1列出分析数据A并求和 2如Σ与100%有较大偏差,则应修正为B,b=ā/∑; 3列出各氧化物分子量数据C; 51
51 水。 5、结构水:又称化合水。是以(OH-)、H+、(H3O+)离子形式参 加矿物晶格的“水”。结构水在晶格中占有一定位置,在组成上具有 确定的含量比。由于与其它质点有较强的键力联系,需要较高的温度 (大约在 600-1000℃)才能逸出。当其逸出后,结构完全破坏, 晶体结构重新改组。 五、 矿物的晶体化学式 晶体化学式(或结构式)既可表明矿物中各组分的种类,又能反 映矿物中原子的结合情况。其书写方法如下: 1)阳离子写在先,复盐中阳离子按碱性强弱排列。 2)阴离子写在后,络阴离子用方括号[ ]括起。 3)附加阴离子写在主要阴离子或络阴离子的后面。 4)含水化合物的水分子写在最后,并用“ ”与其它组分分开。当含 水量不定时,用 nH2O 或 aq(aquq—含水的缩写)表示。SiO2·aq 或 Ca[SO4]·2H2O。 5) 互为类质同象代替的离子用圆括号()括起来,它们中间以“,” 分开,含量较多的元素一般写在前面。Ca(Mg,Fe,Mn)[CO3]2 - 铁白云石。 计算步骤与实例:计算橄榄石(Mg,Fe)2[SiO4]的晶体化学式: 1 列出分析数据 A 并求和∑; 2 如∑与 100%有较大偏差, 则应修正为 B, b=a/∑; 3 列出各氧化物分子量数据 C;
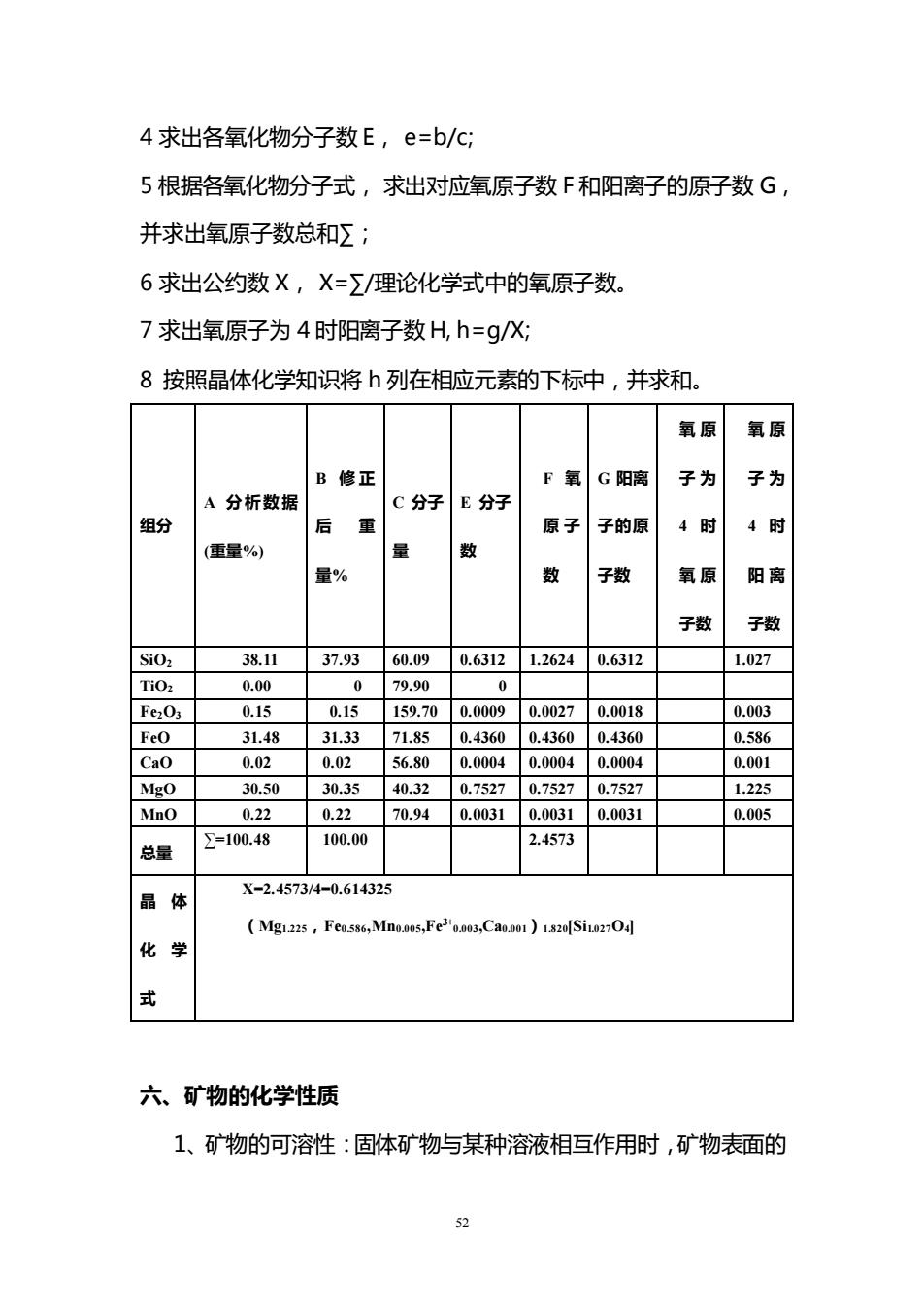
4求出各氧化物分子数E,e=b/c; 5根据各氧化物分子式,求出对应氧原子数F和阳离子的原子数G, 并求出氧原子数总和Σ; 6求出公约数X,X=∑/理论化学式中的氧原子数。 7求出氧原子为4时阳离子数H,h=g/X 8按照晶体化学知识将h列在相应元素的下标中,并求和. 氧原 氧原 B修正 F氧G阳离 子为 子为 A分析数据 C分子E分子 组分 后重 原子子的原 4时 4时 (重量%) 量 数 量% 数 子数 氧原 阳离 子数 子数 38.11 37.9360.090.63121.26240.6312 1.027 TiO 0.00 0 79.90 0 FeO 0.15 0.15 159.700.00090.00270.0018 0.003 FeO 31.48 31.3371.850.43600.43600.4360 0.586 Cao 0.02 0.02 56.80 0.00040.0004 0.0004 0.001 Mgo 30.50 30.35 40.320.75270.75270.7527 1.225 Mno 0.22 0.22 70.940.00310.00310.0031 0.005 总量 =100.48 100.00 2.4573 品体 X=2.4573/4=0.614325 化学 六、矿物的化学性质 1、矿物的可溶性:固体矿物与某种溶液相互作用时,矿物表面的
52 4 求出各氧化物分子数 E, e=b/c; 5 根据各氧化物分子式, 求出对应氧原子数 F 和阳离子的原子数 G, 并求出氧原子数总和∑; 6 求出公约数 X, X=∑/理论化学式中的氧原子数。 7 求出氧原子为 4 时阳离子数 H, h=g/X; 8 按照晶体化学知识将 h 列在相应元素的下标中,并求和。 组分 A 分析数据 (重量%) B 修 正 后 重 量% C 分子 量 E 分子 数 F 氧 原 子 数 G 阳离 子的原 子数 氧 原 子 为 4 时 氧 原 子数 氧 原 子 为 4 时 阳 离 子数 SiO2 38.11 37.93 60.09 0.6312 1.2624 0.6312 1.027 TiO2 0.00 0 79.90 0 Fe2O3 0.15 0.15 159.70 0.0009 0.0027 0.0018 0.003 FeO 31.48 31.33 71.85 0.4360 0.4360 0.4360 0.586 CaO 0.02 0.02 56.80 0.0004 0.0004 0.0004 0.001 MgO 30.50 30.35 40.32 0.7527 0.7527 0.7527 1.225 MnO 0.22 0.22 70.94 0.0031 0.0031 0.0031 0.005 总量 ∑=100.48 100.00 2.4573 晶 体 化 学 式 X=2.4573/4=0.614325 (Mg1.225,Fe0.586,Mn0.005,Fe3+0.003,Ca0.001)1.820[Si1.027O4] 六、矿物的化学性质 1、矿物的可溶性:固体矿物与某种溶液相互作用时,矿物表面的