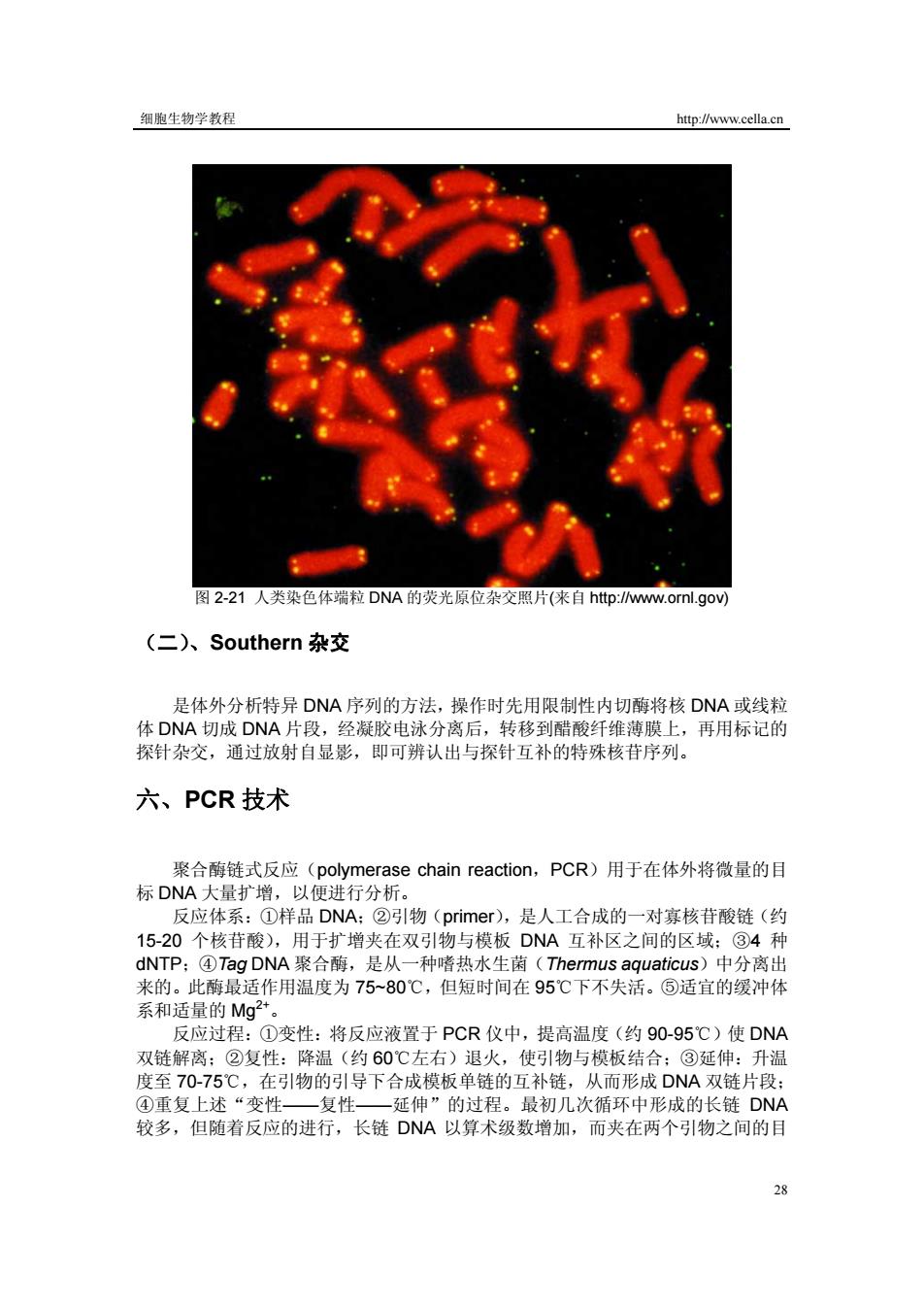
细胞生物学教程 http://www.cella.cn 图2-21人类染色体端粒DNA的荧光原位杂交照片(来自http://www..ornl.gov) (二)、Southern杂交 是体外分析特异DNA序列的方法,操作时先用限制性内切酶将核DNA或线粒 体DNA切成DNA片段,经凝胶电泳分离后,转移到醋酸纤维薄膜上,再用标记的 探针杂交,通过放射自显影,即可辨认出与探针互补的特殊核苷序列。 六、PCR技术 聚合酶链式反应(polymerase chain reaction,PCR)用于在体外将微量的目 标DNA大量扩增,以便进行分析。 反应体系:①样品DNA:②引物(primer)),是人工合成的一对寡核苷酸链(约 15-20个核苷酸),用于扩增夹在双引物与模板DNA互补区之间的区域:③4种 dNTP;④Tag DNA聚合酶,是从一种嗜热水生菌(Thermus aquaticus)中分离出 来的。此酶最适作用温度为75~80℃,但短时间在95℃下不失活。⑤适宜的缓冲体 系和适量的Mg2+。 反应过程:①变性:将反应液置于PCR仪中,提高温度(约90-95℃)使DNA 双链解离:②复性:降温(约60℃左右)退火,使引物与模板结合:③延伸:升温 度至70-75℃,在引物的引导下合成模板单链的互补链,从而形成DNA双链片段: ④重复上述“变性一复性一延伸”的过程。最初几次循环中形成的长链DNA 较多,但随着反应的进行,长链DNA以算术级数增加,而夹在两个引物之间的目 28
细胞生物学教程 http://www.cella.cn 28 图 2-21 人类染色体端粒 DNA 的荧光原位杂交照片(来自 http://www.ornl.gov) (二)、Southern 杂交 是体外分析特异 DNA 序列的方法,操作时先用限制性内切酶将核 DNA 或线粒 体 DNA 切成 DNA 片段,经凝胶电泳分离后,转移到醋酸纤维薄膜上,再用标记的 探针杂交,通过放射自显影,即可辨认出与探针互补的特殊核苷序列。 六、PCR 技术 聚合酶链式反应(polymerase chain reaction,PCR)用于在体外将微量的目 标 DNA 大量扩增,以便进行分析。 反应体系:①样品 DNA;②引物(primer),是人工合成的一对寡核苷酸链(约 15-20 个核苷酸),用于扩增夹在双引物与模板 DNA 互补区之间的区域;③4 种 dNTP;④Tag DNA 聚合酶,是从一种嗜热水生菌(Thermus aquaticus)中分离出 来的。此酶最适作用温度为 75~80℃,但短时间在 95℃下不失活。⑤适宜的缓冲体 系和适量的 Mg2+。 反应过程:①变性:将反应液置于 PCR 仪中,提高温度(约 90-95℃)使 DNA 双链解离;②复性:降温(约 60℃左右)退火,使引物与模板结合;③延伸:升温 度至 70-75℃,在引物的引导下合成模板单链的互补链,从而形成 DNA 双链片段; ④重复上述“变性——复性——延伸”的过程。最初几次循环中形成的长链 DNA 较多,但随着反应的进行,长链 DNA 以算术级数增加,而夹在两个引物之间的目

细胞生物学教程 http://www.cella.cn 标DNA以指数级数增长,经大约20一30次循环后,扩增产物中主要是目标DNA。 第三节细胞分离技术 一、离心技术 离心是研究如细胞核、线粒体、高尔基体、溶酶体和微体,以及各种大分子基 本手段。一般认为,转速为10~25 Kr/min的离心机称为高速离心机:转速超过 25 Kr/min,离心力大于89Kg者称为超速离心机。目前超速离心机的最高转速可达 100 Kr/min,离心力超过500Kg。 (一)、差速离心(differential centrifugation) 在密度均一的介质中由低速到高速逐级离心,用于分离不同大小的细胞和细胞 器(图2-22)。 在差速离心中细胞器沉降的顺序依次为:核、线粒体、溶酶体与过氧化物酶体、 内质网与高基体、最后为核蛋白体。 由于各种细胞器在大小和密度上相互重叠,而且某些慢沉降颗粒常常被快沉降 颗粒裹到沉淀块中,一般重复23次效果会好一些。 差速离心只用于分离大小悬殊的细胞,更多用于分离细胞器。通过差速离心可 将细胞器初步分离,常需进一步通过密度梯离心再行分离纯化。 0:1:1 图2-22速度逐渐提高,样品按大小先后沉淀 (二)、密度梯度离心(density gradient centrifugation) 用一定的介质在离心管内形成一连续或不连续的密度梯度,将细胞混悬液或匀 浆置于介质的顶部,通过重力或离心力场的作用使细胞分层、分离。这类分离又可 分为速度沉降和等密度沉降平衡两种(图2-23)。密度梯度离心常用的介质为氯化 铯,蔗糖和多聚蔗糖。分离活细胞的介质要求:1)能产生密度梯度,且密度高时, 29
细胞生物学教程 http://www.cella.cn 29 标 DNA 以指数级数增长,经大约 20—30 次循环后,扩增产物中主要是目标 DNA。 第三节 细胞分离技术 一、离心技术 离心是研究如细胞核、线粒体、高尔基体、溶酶体和微体,以及各种大分子基 本手段。一般认为,转速为 10~25Kr/min 的离心机称为高速离心机;转速超过 25Kr/min,离心力大于 89Kg者称为超速离心机。目前超速离心机的最高转速可达 100Kr/min,离心力超过 500Kg。 (一)、差速离心(differential centrifugation) 在密度均一的介质中由低速到高速逐级离心,用于分离不同大小的细胞和细胞 器(图 2-22)。 在差速离心中细胞器沉降的顺序依次为:核、线粒体、溶酶体与过氧化物酶体、 内质网与高基体、最后为核蛋白体。 由于各种细胞器在大小和密度上相互重叠,而且某些慢沉降颗粒常常被快沉降 颗粒裹到沉淀块中,一般重复 2~3 次效果会好一些。 差速离心只用于分离大小悬殊的细胞,更多用于分离细胞器。通过差速离心可 将细胞器初步分离,常需进一步通过密度梯离心再行分离纯化。 图 2-22 速度逐渐提高,样品按大小先后沉淀 (二)、密度梯度离心(density gradient centrifugation) 用一定的介质在离心管内形成一连续或不连续的密度梯度,将细胞混悬液或匀 浆置于介质的顶部,通过重力或离心力场的作用使细胞分层、分离。这类分离又可 分为速度沉降和等密度沉降平衡两种(图 2-23)。密度梯度离心常用的介质为氯化 铯,蔗糖和多聚蔗糖。分离活细胞的介质要求:1)能产生密度梯度,且密度高时

细胞生物学教程 http://www.cella.cn 粘度不高:2)PH中性或易调为中性:3)浓度大时渗透压不大:4)对细胞无毒。 (A) sample slow-sedimenting stabilizing component sucrose gradient fast-sedimenting component ·CENTRIFUGATION→ FRACTIONATION- U5666066 (B) low buoyant density sample component steep high buoyant sucrose density gradient component (e.9,20-70%) From The Art of MBoC3 1995 Garland Publishing,Inc. 图2-23A等速度沉降,B等密度沉降 1、速度沉降 速度沉降(velocity sedimentation)主要用于分离密度相近而大小不等的细胞 或细胞器。这种降方法所采用的介质密度较低,介质的最大密度应小于被分离生物 颗粒的最小密度。 生物颗粒(细胞或细器)在十分平缓的密度梯度介质中按各自的沉降系数以不 同的速度沉降而达到分离。 2、等密度沉降 等密度沉降(isopycnic sedimentation)适用于分离密度不等的颗粒。 细胞或细胞器在连续梯度的介质中经足够大离心力和是够长时间则沉降或漂浮 到与自身密度相等的介质处,并停留在那里达到平衡,从而将不同密度的细胞或细 胞器分离。 等密度沉降通常在较高密度的介质中进行。介质的最高密度应大于被分离组分 的最大密度,而且介质的梯度要求较高的陡度,不能太平缓。再者,这种方法所需 要的力场通常比速率沉降法大10~100倍,故往往需要高速或超速离心,离心时间 也较长。大的离心力、长的离心时间都对细胞不利。大细胞比小细胞更易受高离心 30
细胞生物学教程 http://www.cella.cn 30 粘度不高;2)PH 中性或易调为中性;3)浓度大时渗透压不大;4)对细胞无毒。 图 2-23 A 等速度沉降,B 等密度沉降 1、速度沉降 速度沉降(velocity sedimentation)主要用于分离密度相近而大小不等的细胞 或细胞器。这种降方法所采用的介质密度较低,介质的最大密度应小于被分离生物 颗粒的最小密度。 生物颗粒(细胞或细器)在十分平缓的密度梯度介质中按各自的沉降系数以不 同的速度沉降而达到分离。 2、等密度沉降 等密度沉降(isopycnic sedimentation)适用于分离密度不等的颗粒。 细胞或细胞器在连续梯度的介质中经足够大离心力和是够长时间则沉降或漂浮 到与自身密度相等的介质处,并停留在那里达到平衡,从而将不同密度的细胞或细 胞器分离。 等密度沉降通常在较高密度的介质中进行。介质的最高密度应大于被分离组分 的最大密度,而且介质的梯度要求较高的陡度,不能太平缓。再者,这种方法所需 要的力场通常比速率沉降法大 10~100 倍,故往往需要高速或超速离心,离心时间 也较长。大的离心力、长的离心时间都对细胞不利。大细胞比小细胞更易受高离心
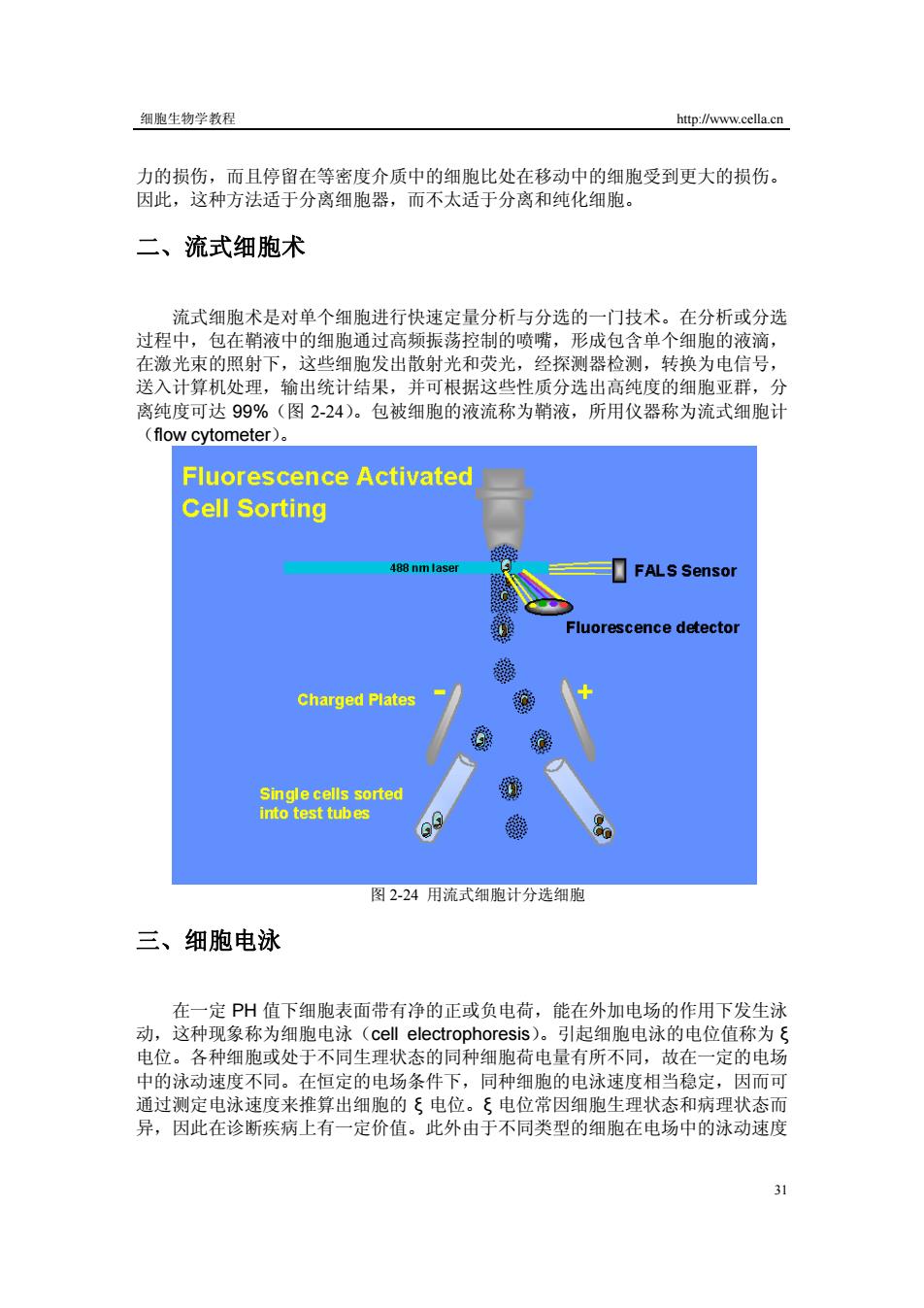
细胞生物学教程 http://www.cella.cn 力的损伤,而且停留在等密度介质中的细胞比处在移动中的细胞受到更大的损伤。 因此,这种方法适于分离细胞器,而不太适于分离和纯化细胞。 二、流式细胞术 流式细胞术是对单个细胞进行快速定量分析与分选的一门技术。在分析或分选 过程中,包在鞘液中的细胞通过高频振荡控制的喷嘴,形成包含单个细胞的液滴, 在激光束的照射下,这些细胞发出散射光和荧光,经探测器检测,转换为电信号, 送入计算机处理,输出统计结果,并可根据这些性质分选出高纯度的细胞亚群,分 离纯度可达99%(图2-24)。包被细胞的液流称为鞘液,所用仪器称为流式细胞计 (flow cytometer). Fluorescence Activated Cell Sorting 488 nm laser FALS Sensor Fluorescence detector 羲 Charged Plates Single cells sorted into test tubes 图2-24用流式细胞计分选细胞 三、细胞电泳 在一定PH值下细胞表面带有净的正或负电荷,能在外加电场的作用下发生泳 动,这种现象称为细胞电泳(cell electrophoresis)。引起细胞电泳的电位值称为ξ 电位。各种细胞或处于不同生理状态的同种细胞荷电量有所不同,故在一定的电场 中的泳动速度不同。在恒定的电场条件下,同种细胞的电泳速度相当稳定,因而可 通过测定电泳速度来推算出细胞的ξ电位。ξ电位常因细胞生理状态和病理状态而 异,因此在诊断疾病上有一定价值。此外由于不同类型的细胞在电场中的泳动速度 31
细胞生物学教程 http://www.cella.cn 31 力的损伤,而且停留在等密度介质中的细胞比处在移动中的细胞受到更大的损伤。 因此,这种方法适于分离细胞器,而不太适于分离和纯化细胞。 二、流式细胞术 流式细胞术是对单个细胞进行快速定量分析与分选的一门技术。在分析或分选 过程中,包在鞘液中的细胞通过高频振荡控制的喷嘴,形成包含单个细胞的液滴, 在激光束的照射下,这些细胞发出散射光和荧光,经探测器检测,转换为电信号, 送入计算机处理,输出统计结果,并可根据这些性质分选出高纯度的细胞亚群,分 离纯度可达 99%(图 2-24)。包被细胞的液流称为鞘液,所用仪器称为流式细胞计 (flow cytometer)。 图 2-24 用流式细胞计分选细胞 三、细胞电泳 在一定 PH 值下细胞表面带有净的正或负电荷,能在外加电场的作用下发生泳 动,这种现象称为细胞电泳(cell electrophoresis)。引起细胞电泳的电位值称为 ξ 电位。各种细胞或处于不同生理状态的同种细胞荷电量有所不同,故在一定的电场 中的泳动速度不同。在恒定的电场条件下,同种细胞的电泳速度相当稳定,因而可 通过测定电泳速度来推算出细胞的 ξ 电位。ξ 电位常因细胞生理状态和病理状态而 异,因此在诊断疾病上有一定价值。此外由于不同类型的细胞在电场中的泳动速度

细胞生物学教程 http://www.cella.cn 不同,细胞电泳尚可用来分离不同种类的细胞,例如可把淋巴样细胞与造血细胞分 开。 第四节细胞培养与细胞杂交 一、细胞培养 高等生物是由多细胞构成的整体,在整体条件下要研究单个细胞或某一群细胞 在体内(in vivo)的功能活动是十分困难的。但是如果把活细胞拿到体外(in vitro) 培养进行观察和研究,则要方便得多。活细胞离体后要在一定的生理条件下才能存 活和进行生理活动,特别是高等动植物细胞要求的生存条件极其严格,稍有不适就 要死亡。所以细胞培养技术(cell culture)就是选用最佳生存条件对活细胞进行培 养和研究的技术。 动物细胞的生存环境与植物细胞差别很大,因而二者的培养方法很不相同。 (一)、动物细胞培养 细胞培养方式大致可分为两种(图2-25):一种是群体培养(mass culture), 将含有一定数量细胞的悬液置于培养瓶中,让细胞贴壁生长,汇合(confluence) 后形成均匀的单细胞层;另一种是克隆培养(clonal culture),将高度稀释的游离细 胞悬液加入培养瓶中,各个细胞贴壁后,彼此距离较远,经过生长增殖每一个细胞 形成一个细胞集落,称为克隆(cloe)。一个细胞克隆中的所有细胞均来源于同一 个祖先细胞。此外,为了制取细胞产品而设计了转鼓培养法,使用大容量的圆培养 瓶,在培养过程中不断地转动,使培养的细胞始终处于悬浮状态之中而不贴壁。 图2-25群体培养(左)和克隆培养(右) 32
细胞生物学教程 http://www.cella.cn 32 不同,细胞电泳尚可用来分离不同种类的细胞,例如可把淋巴样细胞与造血细胞分 开。 第四节 细胞培养与细胞杂交 一、细胞培养 高等生物是由多细胞构成的整体,在整体条件下要研究单个细胞或某一群细胞 在体内(in vivo)的功能活动是十分困难的。但是如果把活细胞拿到体外(in vitro) 培养进行观察和研究,则要方便得多。活细胞离体后要在一定的生理条件下才能存 活和进行生理活动,特别是高等动植物细胞要求的生存条件极其严格,稍有不适就 要死亡。所以细胞培养技术(cell culture)就是选用最佳生存条件对活细胞进行培 养和研究的技术。 动物细胞的生存环境与植物细胞差别很大,因而二者的培养方法很不相同。 (一)、动物细胞培养 细胞培养方式大致可分为两种(图 2-25):一种是群体培养(mass culture), 将含有一定数量细胞的悬液置于培养瓶中,让细胞贴壁生长,汇合(confluence) 后形成均匀的单细胞层;另一种是克隆培养(clonal culture),将高度稀释的游离细 胞悬液加入培养瓶中,各个细胞贴壁后,彼此距离较远,经过生长增殖每一个细胞 形成一个细胞集落,称为克隆(clone)。一个细胞克隆中的所有细胞均来源于同一 个祖先细胞。此外,为了制取细胞产品而设计了转鼓培养法,使用大容量的圆培养 瓶,在培养过程中不断地转动,使培养的细胞始终处于悬浮状态之中而不贴壁。 图 2-25 群体培养(左)和克隆培养(右)