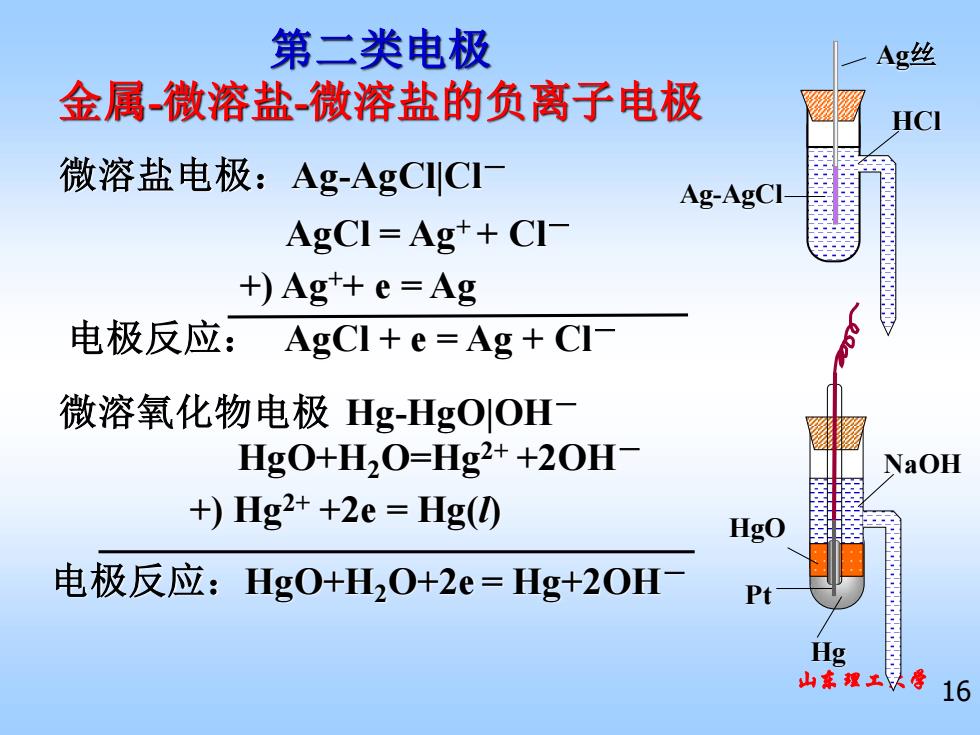
第二类电极 Ag丝 金属微溶盐微溶盐的负离子电极 HCI 微溶盐电极:Ag-AgCICI Ag-AgCI- AgCI=Ag++CI +)Agt+e=Ag 电极反应:AgCl+e=Ag+CI 微溶氧化物电极Hg-HgOOH Hg0+H20=Hg2++20H NaOH +)Hg2++2e=Hlg(0 HgO 电极反应:Hg0+H20+2e=Hg+2OH- P Hg 理学16
山东理工大学 16 微溶盐电极:Ag-AgCl|Cl- 微溶氧化物电极 Hg-HgO|OH- 电极反应: AgCl + e = Ag + Cl- 第二类电极 金属-微溶盐-微溶盐的负离子电极 电极反应:HgO+H2O+2e = Hg+2OH- AgCl = Ag+ + Cl- +) Ag++ e = Ag HgO+H2O=Hg2+ +2OH- +) Hg2+ +2e = Hg(l) Hg HgO NaOH Pt Ag-AgCl Ag丝 HCl

第二类电极的电极反应 电极 电极反应(还原) CI(a )IAgCI(s)1Ag(s) AgCI(s)+e>Ag(s)+CI (a) CI(a)Hg2Cl2(s)Hg(1) Hg2 Cl2(s)+2e →2Hg①)+2C(a) H'(a.)1 Ag2O(s)1 Ag(s)Ag2O(s)+2H(a.)+2e →2Ag(S)+H,OI) OH(a)Ag,O(s)Ag(s)Ag,O(s)+2H,O+2e →2AgS)+2架47
山东理工大学 17 Cl ( ) AgCl(s) Ag(s) a − − ㅣ ㅣ AgCl(s) e Ag(s) Cl ( ) a − − − + → + Cl ( ) Hg Cl (s) Hg(l) 2 2 a − − ㅣ ㅣ Hg Cl (s) 2e 2 2 − + 2Hg(l) 2Cl ( ) a − − ⎯⎯→ + H ( ) Ag O(s) Ag(s) 2 a + + ㅣ ㅣ Ag O(s) 2H ( ) 2e 2 a + + − + + 2 ⎯⎯→2Ag(s) H O(l) + OH ( ) Ag O(s) Ag(s) 2 a − − ㅣ ㅣ Ag O(s) 2H O 2e 2 2 − + + 2Ag(s) 2OH ( ) a − − ⎯⎯→ + 第二类电极的电极反应 电极 电极反应(还原)

第二类电极的应用意义: 1、许多负离子没有对应的第一类电极,但可制 成第二类电极。如S042-,C2042- Hg-Hg2SOSO2, 2、OH一,C一虽有对应的第一类电极,但也常制 成第二类电极,因为制备容易,使用方便。 山东魏工大导18
山东理工大学 18 1、许多负离子没有对应的第一类电极,但可制 成第二类电极。如 SO4 2-,C2O4 2- Hg-Hg2SO4 |SO4 2-, 第二类电极的应用意义: 2、OH-, Cl-虽有对应的第一类电极,但也常制 成第二类电极,因为制备容易,使用方便
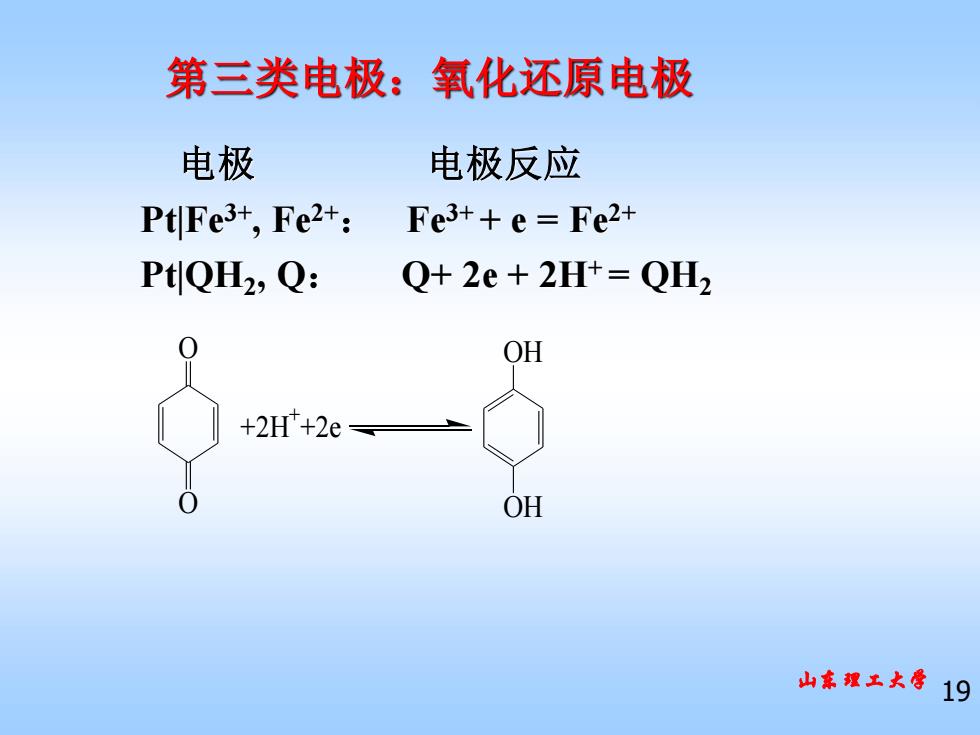
第三类电极:氧化还原电极 电极 电极反应 PtFe3+,Fe2+: Fe3++e=Fe2+ PtQH2,Q: Q+2e+2H+=QH2 OH +2H+2e OH 山理土大导19
山东理工大学 19 第三类电极:氧化还原电极 电极 电极反应 Pt|Fe3+, Fe2+: Fe3+ + e = Fe2+ Pt|QH2 , Q: Q+ 2e + 2H+ = QH2 O O +2H ++2e OH OH

第三类电极的电极反应 电极 电极反应(还原) Fe(a),Fe2(a,)Pt Fe3(a)+e→Fe2+(a2) Sn(a),Sn2(a)Pt Sn4+(a)+2e→Sn2+(a2) Cu2(a),Cu"(az)Pt Cu2+(a)+e→Cu+(a2) 山东理工大学20
山东理工大学 20 3 2 Fe ( ), Fe ( ) Pt 1 2 a a + + | 3 2 1 2 Fe ( ) e Fe ( ) a a + + − + → 2 Cu ( ), Cu ( ) Pt 1 2 a a + + | 2 Cu ( ) e Cu ( ) 1 2 a a + + − + → 4 2 Sn ( ), Sn ( ) Pt 1 2 a a + + | 4 2 1 2 Sn ( ) 2e Sn ( ) a a + + − + → 第三类电极的电极反应 电极 电极反应(还原)