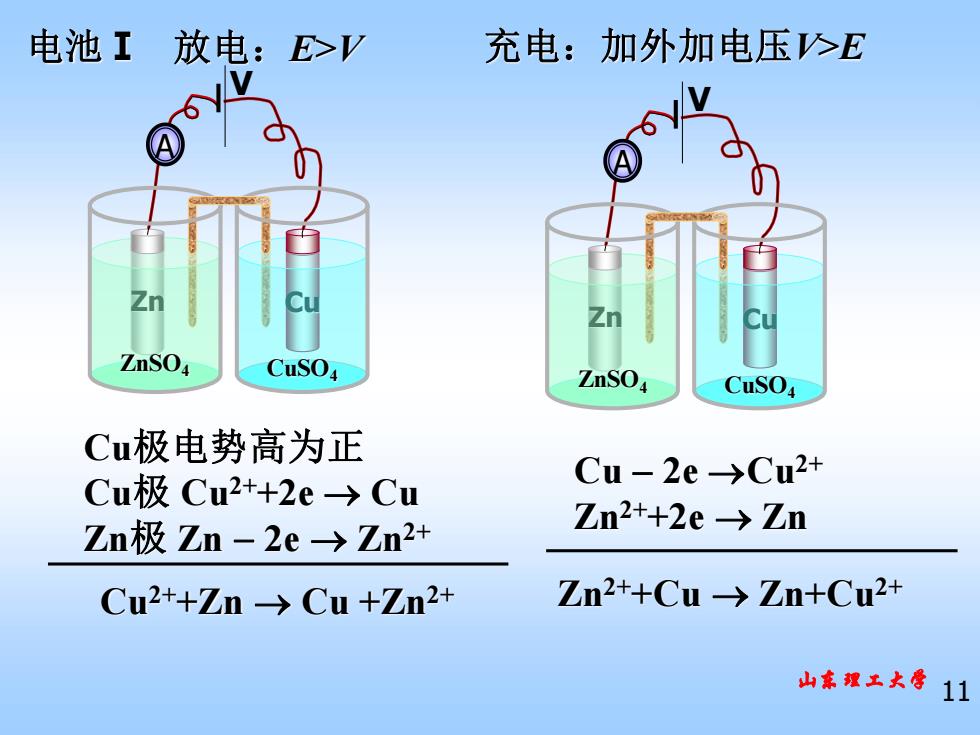
电池工 放电:E>V 充电:加外加电压>E ZnSO CuSO ZnSO CuSO Cu极电势高为正 Cu极Cu2++2e→Cu Cu-2e→Cu2+ Zn极Zn-2e→Zn2+ Zn2++2e→Zn Cu2++Zn→Cu+Zn2+ Zn2+Cu-→Zn+Cu2+ 山家理工大导11
山东理工大学 11 Cu极电势高为正 Cu极 Cu2++2e → Cu Zn极 Zn − 2e → Zn2+ Cu2++Zn → Cu +Zn2+ 放电:E>V 充电:加外加电压V>E Cu − 2e →Cu2+ Zn2++2e → Zn Zn2++Cu → Zn+Cu2+ 电池Ⅰ Zn Cu ZnSO4 CuSO4 A V Zn Cu ZnSO4 CuSO4 A V
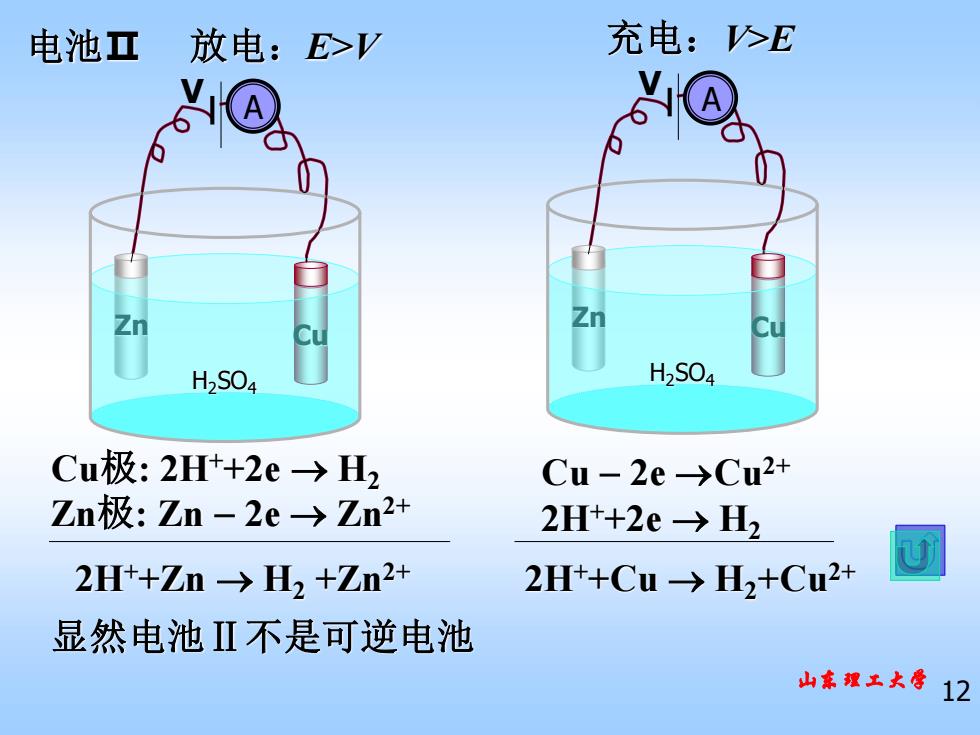
电池亚 放电:E>V 充电:>E H2S04 H2S04 Cu极:2Ht+2e→H2 Cu-2e→Cu2+ Zn极:Zn-2e>Zn2+ 2Ht+2e-→H2 2Ht+Zn-→H2+Zn2+ 2Ht+Cu-→H2+Cu2+ 显然电池Ⅱ不是可逆电池 山东魏土大 712
山东理工大学 12 放电:E>V 充电:V>E Cu极: 2H++2e → H2 Zn极: Zn − 2e → Zn2+ Cu − 2e →Cu2+ 2H++2e → H2 2H++Zn → H2 +Zn2+ 2H++Cu → H2+Cu2+ 电池Ⅱ Cu Zn H2SO4 A V Cu Zn H2SO4 A V 显然电池Ⅱ不是可逆电池

可逆电极的类型 (1)第一类电极 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极 (2)第二类电极 金属-难溶盐及其阴离子组成的电极 金属-氧化物电极 (3)第三类电极 氧化-还原电极 山东魏土大鲁13
山东理工大学 13 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极 金属-难溶盐及其阴离子组成的电极 金属-氧化物电极 氧化-还原电极 ⑴第一类电极 ⑵第二类电极 ⑶第三类电极 可逆电极的类型
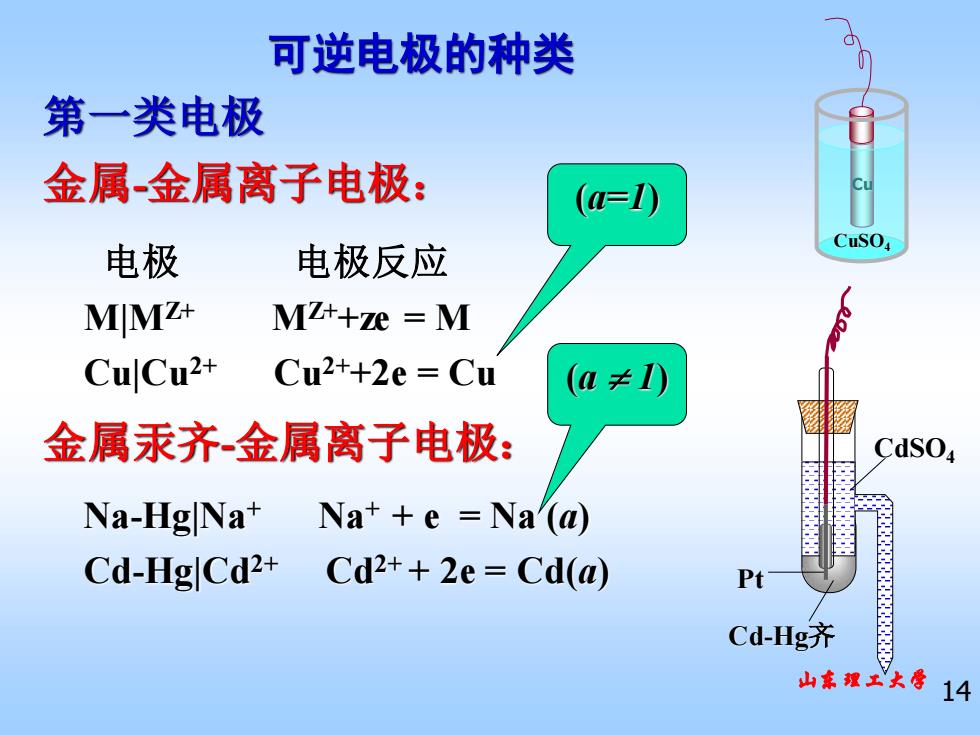
可逆电极的种类 第一类电极 金属金属离子电极: (a=0 CuSO 电极 电极反应 MMZ+ MZ++ze M CuCu2+ Cu2++2e Cu (a≠0 金属汞齐金属离子电极: Na-Hg Na+ Na++e =Na(a) Cd-HgCd2+ Cd2++2e Cd(a) Cd-Hg齐 山东魏工大号14
山东理工大学 14 可逆电极的种类 第一类电极 金属-金属离子电极: Cu CuSO4 Na-Hg|Na+ Na+ + e = Na (a) Cd-Hg|Cd2+ Cd2+ + 2e = Cd(a) 电极 电极反应 M|MZ+ MZ++ze = M Cu|Cu2+ Cu2++2e = Cu 金属汞齐-金属离子电极: (a=1) (a 1) Cd-Hg齐 CdSO4 Pt

铂非金属非金属离子电极(气体电极): (P+)H2H 2H++2e=H2 H P)H2OH- 2H20+2e=H2+20H Pt)02lH20,H+02+4H+4e=2H20 铂 P)0210H 02+2H20+4e=40H PtCLJCI Cl2+2e=2CI- 山家理工大导15
山东理工大学 15 铂-非金属-非金属离子电极(气体电极): (Pt)H2 |H+ 2H++2e=H2 (Pt)H2 |OH- 2H2O+2e=H2+2OH- (Pt)O2 |H2O, H+ O2+4H++4e=2H2O (Pt)O2 |OH- O2+2H2O+4e=4OH- (Pt)Cl2 |Cl- Cl2+2e=2Cl- H2 铂