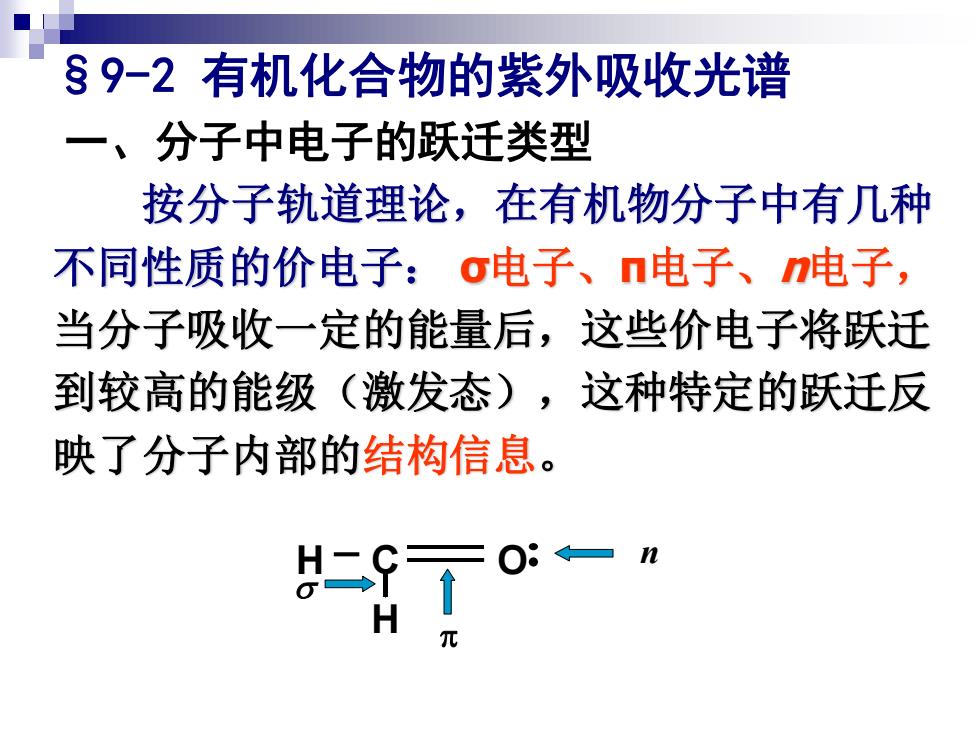
§9-2有机化合物的紫外吸收光谱 一、分子中电子的跃迁类型 按分子轨道理论,在有机物分子中有几种 不同性质的价电子:σ电子、n电子、n电子, 当分子吸收一定的能量后,这些价电子将跃迁 到较高的能级(激发态),这种特定的跃迁反 映了分子内部的结构信息。 二 H 元
C O H n p s H §9-2 有机化合物的紫外吸收光谱 一、分子中电子的跃迁类型 按分子轨道理论,在有机物分子中有几种 不同性质的价电子: σ电子、π电子、n电子, 当分子吸收一定的能量后,这些价电子将跃迁 到较高的能级(激发态),这种特定的跃迁反 映了分子内部的结构信息

一般来说,电子跃迁类型: ●N→V跃迁:由基态轨道跃迁到反键轨道。 ●N→Q跃迁:由分子中未成键的n电子跃迁到反键轨 道。 ●N→R跃迁:由σ电子逐步激发到各个高能级,最后 电离成分子离子的跃迁。 。电荷转移跃迁:在光能激发下,某种化合物(配合 物)中的电荷发生重新分布,导致电荷可从化合物的 一部分迁移至另一部份而产生吸收光谱
一般来说,电子跃迁类型: ● N→V 跃迁:由基态轨道跃迁到反键轨道。 ● N→Q跃迁:由分子中未成键的n电子跃迁到反键轨 道。 ● N→R跃迁:由σ电子逐步激发到各个高能级,最后 电离成分子离子的跃迁。 ● 电荷转移跃迁:在光能激发下,某种化合物(配合 物)中的电荷发生重新分布,导致电荷可从化合物的 一部分迁移至另一部份而产生吸收光谱
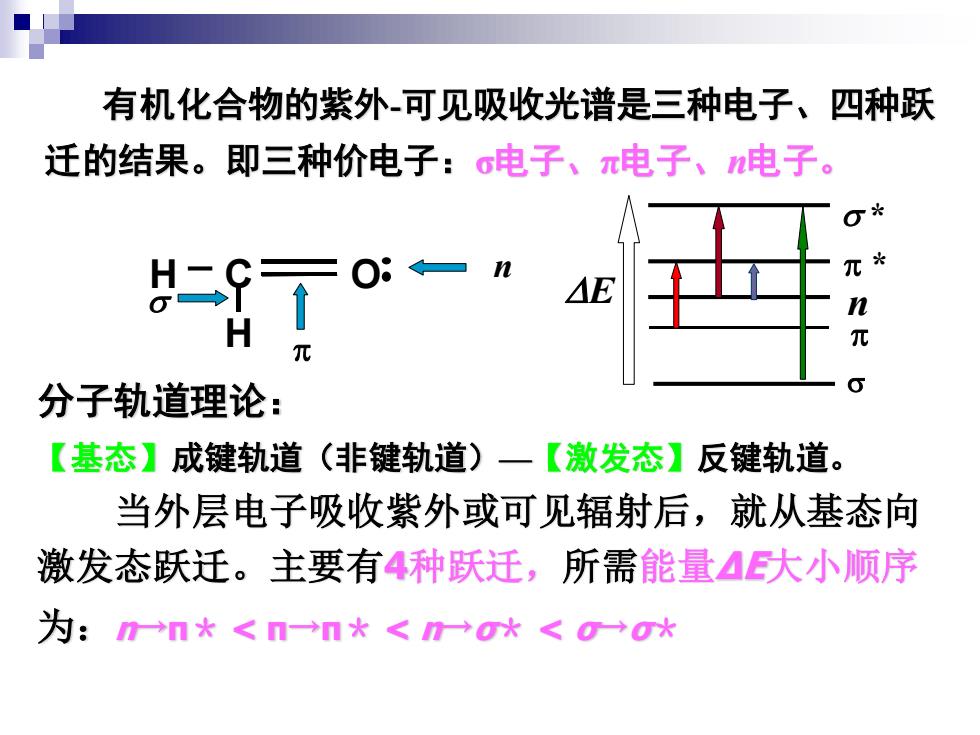
有机化合物的紫外可见吸收光谱是三种电子、四种跃 迁的结果。即三种价电子:c电子、π电子、n电子。 二S7 O8= E n 元 分子轨道理论: 【基态】成键轨道(非键轨道)一【激发态】反键轨道。 当外层电子吸收紫外或可见辐射后,就从基态向 激发态跃迁。主要有4种跃迁,所需能量4大小顺序 为:m→n*<n一→n*<n→o水<g→o*
有机化合物的紫外-可见吸收光谱是三种电子、四种跃 迁的结果。即三种价电子:σ电子、π电子、n电子。 分子轨道理论: 【基态】成键轨道(非键轨道)—【激发态】反键轨道。 当外层电子吸收紫外或可见辐射后,就从基态向 激发态跃迁。主要有4种跃迁,所需能量ΔΕ大小顺序 为:n→π* < π→π* < n→σ* < σ→σ* s p * s * n p E C O H n p s H
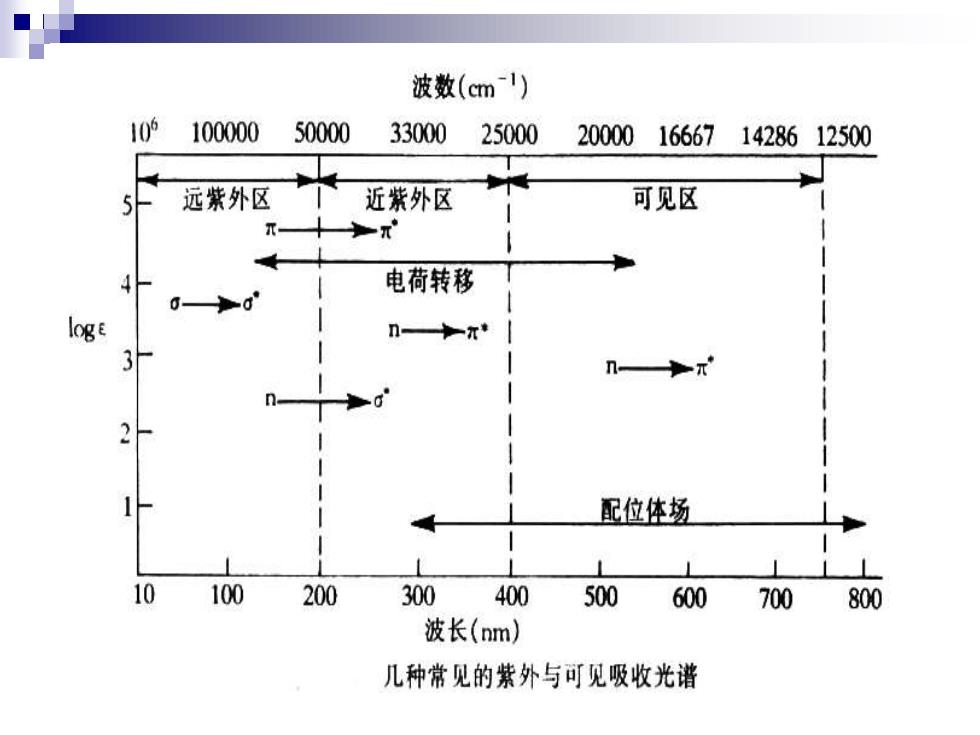
波数(cm1) 10的 100000 50000 33000 25000 20000166671428612500 远紫外区 近紫外区 可见区 电荷转移 0-0 n—π◆ 配位体场 100 200 300 400 500 600 700 800 波长(nm) 几种常见的紫外与可见吸收光谱

1.0→0*跃迁: 饱和烃(甲烷,乙烷) 能量很高,λ<150nm (真空紫外区) 2.n→0*跃迁: 含杂原子饱和基团(一OH,一NH2) 能量较大,λ150250nm(真空紫外区) 3.→兀*跃迁: 不饱和基团(一C=C一,一C=0) 能量较小,λ200nm( 近紫外区) 体系共轭,E更小,λ更大 4.n→兀*跃迁: 含杂原子不饱和基团(一C=N,C=0) 能量最小,λ200ˇ400nm(近紫外区)
1.σ→σ* 跃迁: 饱和烃(甲烷,乙烷) 能量很高,λ<150nm(真空紫外区) 2.n →σ* 跃迁: 含杂原子饱和基团(—OH,—NH2) 能量较大,λ150~250nm(真空紫外区) 3.π→π*跃迁: 不饱和基团(—C=C—,—C = O ) 能量较小,λ~200nm (近紫外区) 体系共轭,E更小,λ更大 4.n→π*跃迁: 含杂原子不饱和基团(—C ≡N ,C= O ) 能量最小,λ 200~400nm(近紫外区)