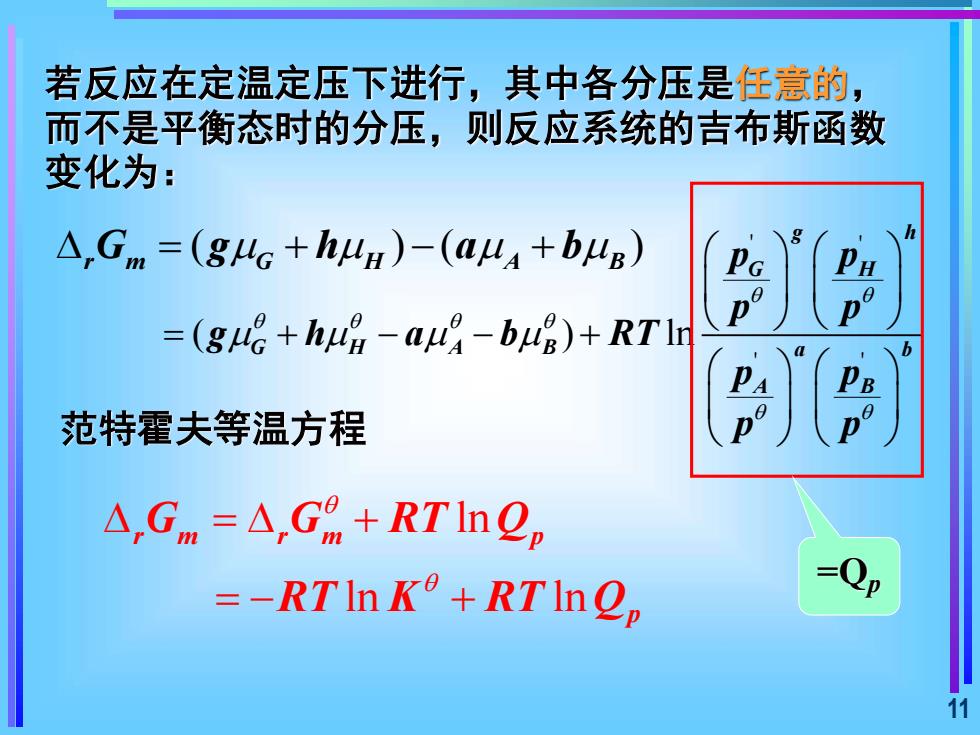
若反应在定温定压下进行,其中各分压是任意的而不是平衡态时的分压,则反应系统的吉布斯函数变化为:A,Gm=(guG+hu)-(au+buB)=(gu+hu-au-bug)+RTlr范特霍夫等温方程A,Gm=A,G" +RTInQ=Qp=-RTInK°+RTInQ11
11 若反应在定温定压下进行,其中各分压是任意的, 而不是平衡态时的分压,则反应系统的吉布斯函数 变化为: ( ) ( ) = + − + r m G H A B G g h a b ' ' ' ' ( ) ln g h G H G H A B a b A B p p p p g h a b RT p p p p = + − − + ln ln ln r m r m p p G G RT Q RT K RT Q = + = − + =Qp 范特霍夫等温方程
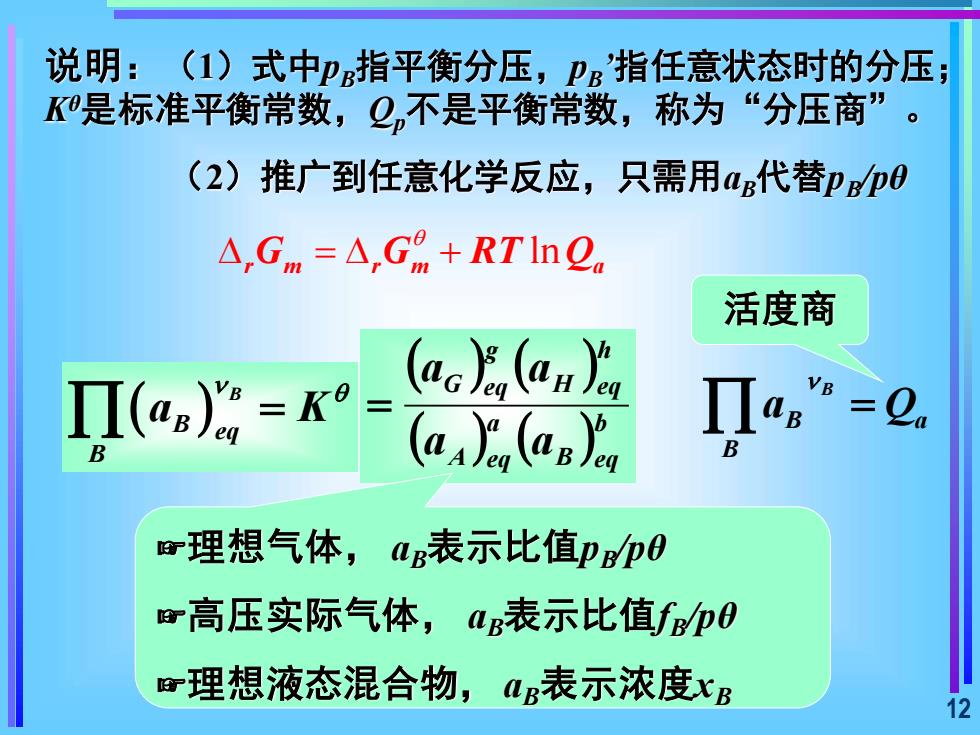
说明:(1)式中p指平衡分压,P指任意状态时的分压K是标准平衡常数,Q,不是平衡常数,称为“分压商”。(2)推广到任意化学反应,只需用aB代替pB/poA,G. =△,G" +RTInQ活度商aH)acIIasII(as)" = KeD:=Q(aA)e,(ag)enBB理想气体,a表示比值p/po高压实际气体,aB表示比值fB/p0理想液态混合物,B表示浓度xB12
12 说明:(1)式中pB指平衡分压,pB ’指任意状态时的分压; Kθ是标准平衡常数,Qp不是平衡常数,称为“分压商”。 (2)推广到任意化学反应,只需用aB代替pB /pθ ln r m r m a G G RT Q = + 活度商 ( ) B B eq B a K = ( ) ( ) ( ) ( ) b B eq a A eq h H eq g G eq a a a a = B B a B a Q = ☞理想气体, aB表示比值pB/pθ ☞高压实际气体, aB表示比值fB/pθ ☞理想液态混合物, aB表示浓度xB

(3)可利用范特霍夫等温方程判别化学反应的方向和限度。△,G =△,G +RTlnQ.=-RTIn K° +RTInQF当Q<K时,4G㎡<0,反应正向自发当Q,>K时,4,Gm>0,反应逆向自发F当Q,=K时,4,Gm=0,反应达平衡p115例113
13 (3)可利用范特霍夫等温方程判别化学反应的方向和 限度。 ln ln ln = + = − + r m r m a a G G RT Q RT K RT Q ☞当Qa < Kθ时,ΔrGm < 0,反应正向自发 ☞当Qa > Kθ时,ΔrGm > 0,反应逆向自发 ☞当Qa = Kθ时,ΔrGm = 0,反应达平衡 p115 例1

S4.2反应的标准吉布斯自由能变化4.G.e一、4,G.和4,G.e的关系二、标准生成吉布斯自由能4,Gme三、反应的4,G.e和Ke的求算14
14 §4.2 反应的标准吉布斯自由能变化rGm 一、rGm和rGm 的关系 二、标准生成吉布斯自由能 fGm 三、反应的rGm 和K 的求算

一、4Gm和4G.e的关系A,Gm=A,G+ RTInQ.14Gme=Eviu,e:()Tp μe一定,4,Gme是一常数A,Gm=EVBUB:()Tp,4,Gm不是常数,与Q.有关24.G可指示反应自发进行的方向;4,Gme即Ke可指示反应的限度,一般情况下不能指示反应自发方向。15
15 一、rGm和rGm 的关系 r Gm r Gm RT Qa = + ln 1 rGm =ii : ( )T,p 一定,rGm 是一常数 rGm =BB : ( )T,p,rGm不是常数,与Qa有关 2 rGm可指示反应自发进行的方向; rGm 即K可指示反应的限度,一般情况下不能 指示反应自发方向