
为什么化学反应通常不能进行到底? 以反应 D+E一>2F为例, 初始 np n 过程中 nE G=npup nEME nFMF 公+nG+n}(以+ra) =n+nE42+ne哈+(n+ne+np)RTln RT(np Inxp +ng In xE +nr Inxr)
为什么化学反应通常不能进行到底? 以反应 D + E —> 2F 为例, 000 D E F D E F nnn nnn 初始 过程中 ( ) G ln ln ln ( ) ln ln ln ln D D E E F F D E F D D E E F F D D E E F F D E F D D E E F F nnn p p p n RT n RT n RT p p p p n n n n n n RT p RT n x n x n x = + + = + + + + + = + + + + + + + +

以反应 D+E一>2F为例, 初始 1 0 过程中 np ne 2(1-no) np+ng+ng 2 G=n,写+,+,+,t:+,RTn易 +RT(np Inxp+ng Inxg+nr Inxr) G={n,(哈+层-22)+2} +2rr,n2+1-,n
以反应 D + E —> 2F 为例, 1 1 0 2(1- ) + + 2 n n n n n n D E D D E F = 初始 过程中 ( ) G ( ) ln ln ln ln D D E E F F D E F D D E E F F p n n n n n n RT p RT n x n x n x = + + + + + + + + ( ) ( ) G= 2 2 1 2 ln 1 ln 2 1 D D E F F D D D D n n n RT n n + − + − + + −
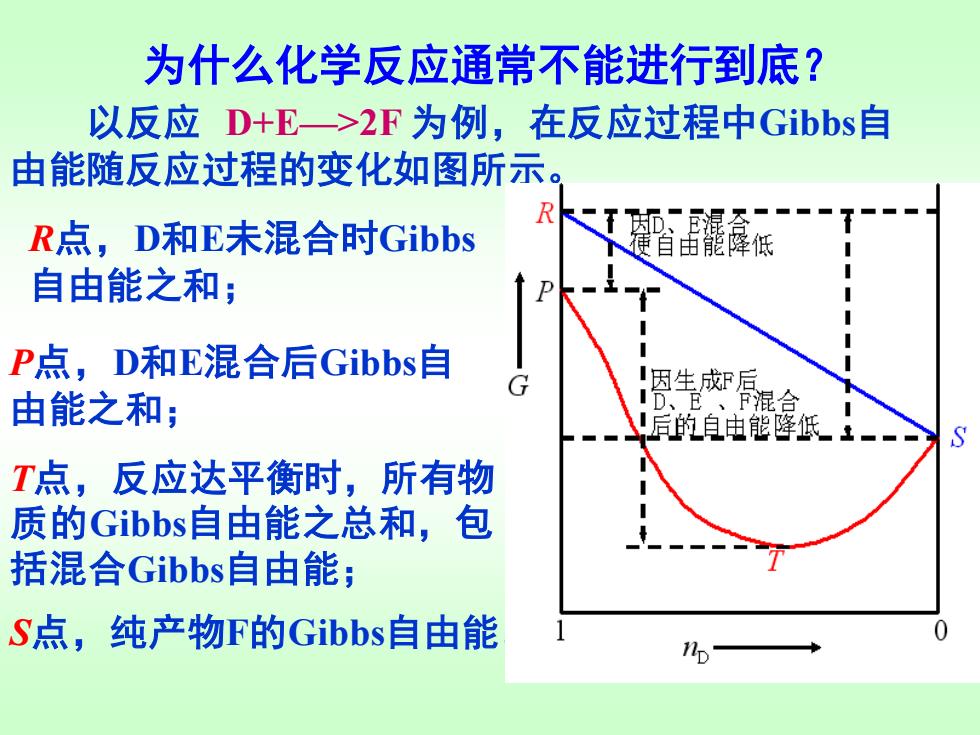
为什么化学反应通常不能进行到底? 以反应D+E一>2F为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 R R点,D和E未混合时Gibbs KT潺 自由能降低 自由能之和; D P点,D和E混合后Gibbs自 因生成F后 由能之和; 0、卫 混合 后的自由能降低- T点,反应达平衡时,所有物 质的Gibbs自由能之总和,包 括混合Gibbs自由能; S点,纯产物F的Gibbs自由能
为什么化学反应通常不能进行到底? 以反应 D+E—>2F 为例,在反应过程中Gibbs自 由能随反应过程的变化如图所示。 R点,D和E未混合时Gibbs 自由能之和; P点,D和E混合后Gibbs自 由能之和; T点,反应达平衡时,所有物 质的Gibbs自由能之总和,包 括混合Gibbs自由能; S点,纯产物F的Gibbs自由能
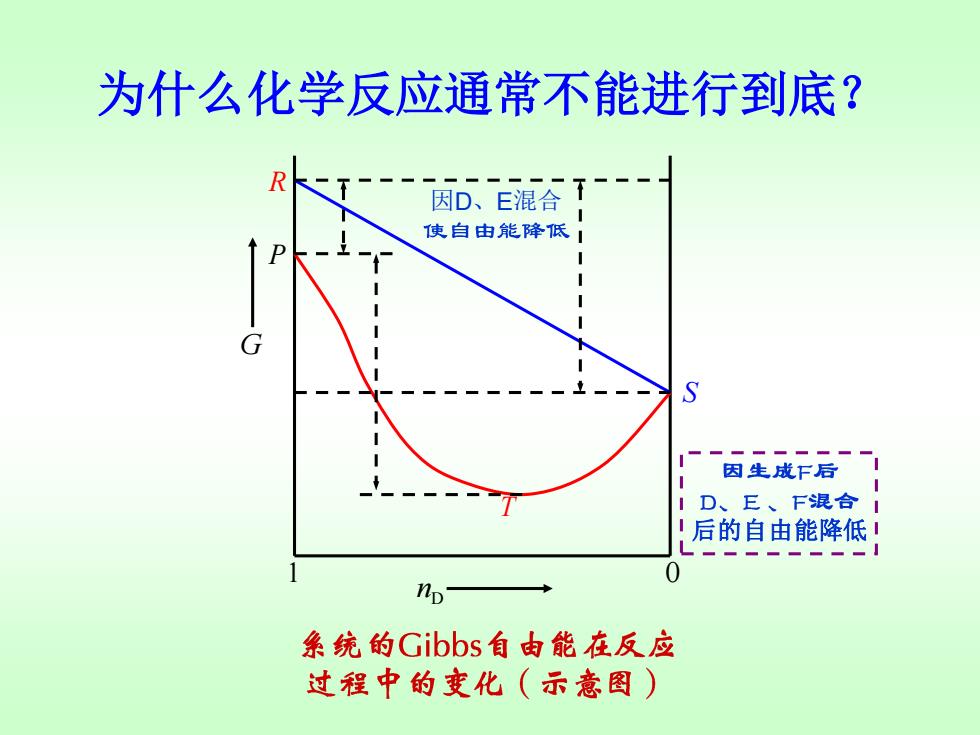
为什么化学反应通常不能进行到底? R 因D、E混合T 使自由能降低! 因生成F后! D、E、F混合I !后的自由能降低! np 系统的Gibbs自由能在反应 过程中的变化(示意图)
为什么化学反应通常不能进行到底? 1 0 D n G R P S T 因D、E混合 后的自由能降低
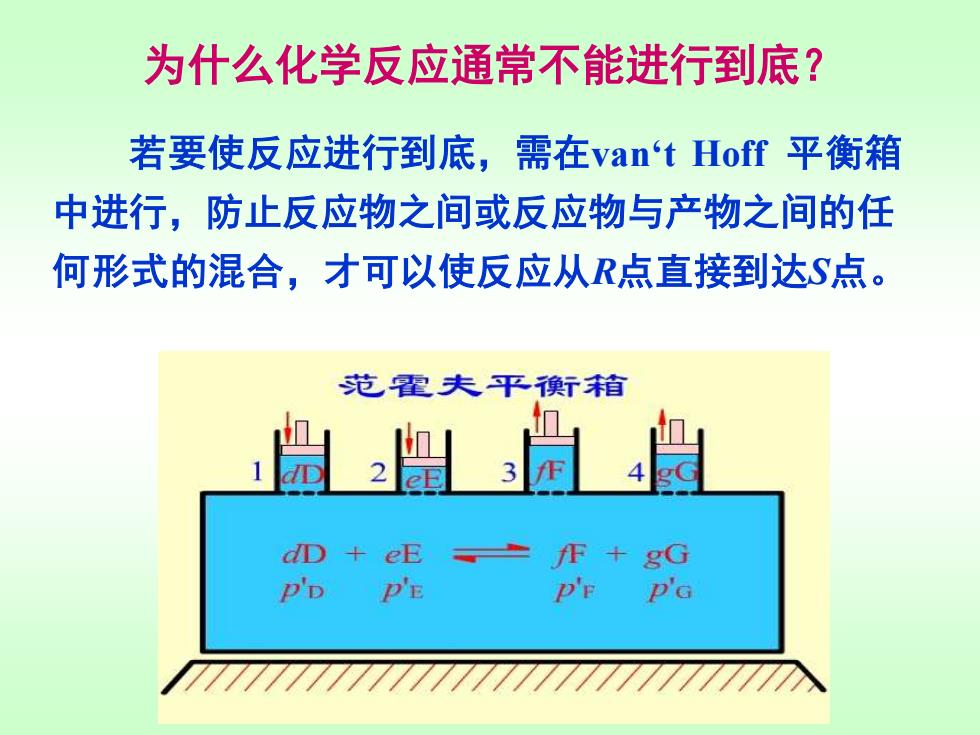
为什么化学反应通常不能进行到底? 若要使反应进行到底,需在van't Hoff平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点。 范霍夫平衡舒箱 dD+eE fF+gG P'D P'E D'E P'G
为什么化学反应通常不能进行到底? 若要使反应进行到底,需在van‘t Hoff 平衡箱 中进行,防止反应物之间或反应物与产物之间的任 何形式的混合,才可以使反应从R点直接到达S点