
化学反应的平衡条件和反应进度ξ的关系 (dG)z,p=∑yB4d5 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势4B保持不变
化学反应的平衡条件和反应进度 的关系 , B B B ( )d d G T p = B B r m T p, B G G = = 这两个公式适用条件: (1)等温、等压、不作非膨胀功的一个化学反应; (2)反应过程中,各物质的化学势 B 保持不变

判断化学反应的方向与限度 用。,4或aCh,作判据都是等效的 (AGm).p<0 反应自发地向右进行 ∑yB4<0 B (A Gm)T.p>0 反应自发地向左进行 ∑4>0 (A:Gm)T.p=O ∑4=0 反应达到平衡
判断化学反应的方向与限度 用 , B r m , 作判据都是等效的 B ( ) , ( ) T p B T p G G 或 r m , ( ) G T p 0 反应自发地向右进行 r m , ( ) 0 G T p 反应自发地向左进行 r m , ( ) 0 G T p = 反应达到平衡 B B B 0 B B B > 0 B B B = 0

判断化学反应的方向与限度 用 a衫 判断,这相当于G~5图上曲线的斜率 T,p 因为是微小变化,反应进度处于0~1mol之间。 G <0 反应自发向右进行,趋向平衡衡 T,P &G >0 反应自发向左进行,趋向平衡 og T,P =0 反应达到平衡 T.p
判断化学反应的方向与限度 用 判断,这相当于 图上曲线的斜率 T p, G G ~ , 0 T p G 反应自发向右进行,趋向平衡 , 0 T p G 反应自发向左进行,趋向平衡 , 0 T p G = 反应达到平衡 因为是微小变化,反应进度处于0~1 mol之间
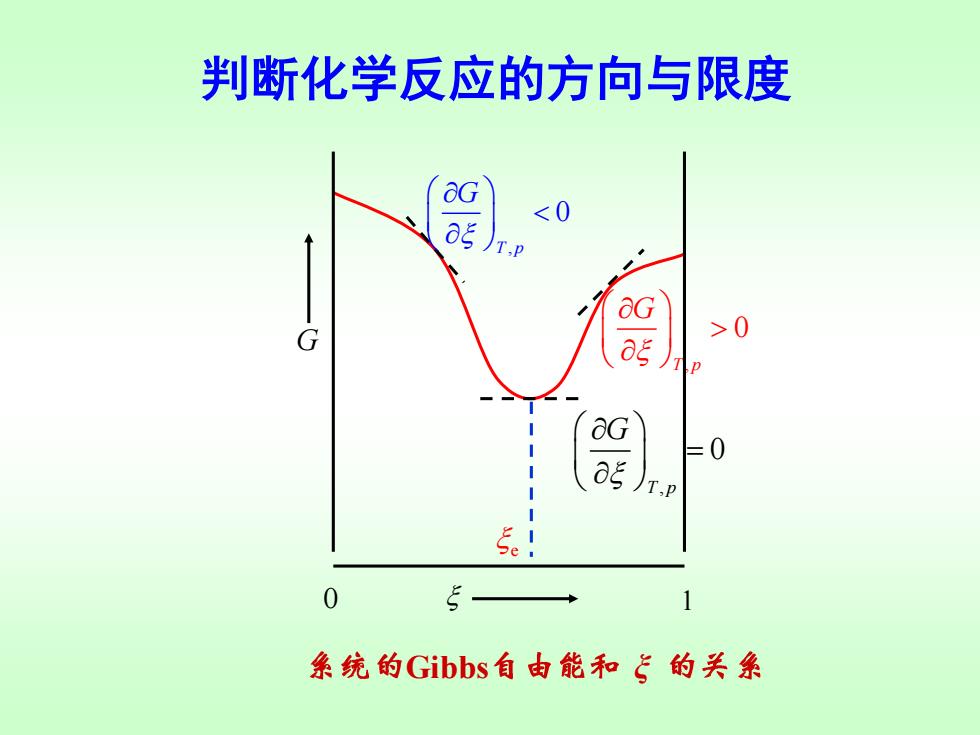
判断化学反应的方向与限度 &G >0 系统的Gibbs自由能和飞的关系
判断化学反应的方向与限度 , 0 T p G , 0 T p G = , 0 T p G Gibbs ξ 0 1 G e

为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故
为什么化学反应通常不能进行到底? 严格讲,反应物与产物处于同一系统的反应都 是可逆的,不能进行到底。 只有逆反应与正反应相比小到可以忽略不计的 反应,可以粗略地认为可以进行到底。这主要是由 于存在混合Gibbs自由能的缘故