
第一节配位化合物的基本概念决定配位数大小的因素:)中心原子电子层结构第二周期元素价层为2s.2p共4个道最多只能容纳4对电子[BeCl4]2-、[BF4]第二周期以后的元素,价层为(n-1)d,ns,np或ns,np,nd,配位数可超过4。[AIF]3-、[SiF]?空间效应:中心原子体积大,配体的体积小,有利于生成配位数大的配离子。[AIF,]3-,[AICl4]-,[BF4]
第一节 配位化合物的基本概念 • 决定配位数大小的因素: ① 中心原子电子层结构 • 第二周期元素价层为2s,2p共4个道最多只能 容纳4对电子 [BeCl4 ] 2-、[BF4 ] - • 第二周期以后的元素,价层为(n-1)d, ns, np 或ns, np, nd,配位数可超过4。 [AlF6 ] 3-、[SiF6 ] 2 ② 空间效应 :中心原子体积大,配体的体积小, 有利于生成配位数大的配离子。 [AlF6 ] 3-, [AlCl4 ] -, [BF4 ] -

第一节配位化合物的基本概念静电作用:中心原子的电荷愈多,愈有利于形成配位数大的配离子[PtC14]2-, [PtCl6]2配体所带的电荷愈多,配体间的斥力就愈大,配位数相应变小[Ni(NH3)]2+,[Ni(CN)4]?-
第一节 配位化合物的基本概念 ③ 静电作用: • 中心原子的电荷愈多,愈有利于形成配位数 大的配离子 [PtCl4 ] 2-, [PtCl6 ] 2- • 配体所带的电荷愈多,配体间的斥力就愈大, 配位数相应变小 [Ni(NH3 )6 ] 2+ , [Ni(CN)4 ] 2-
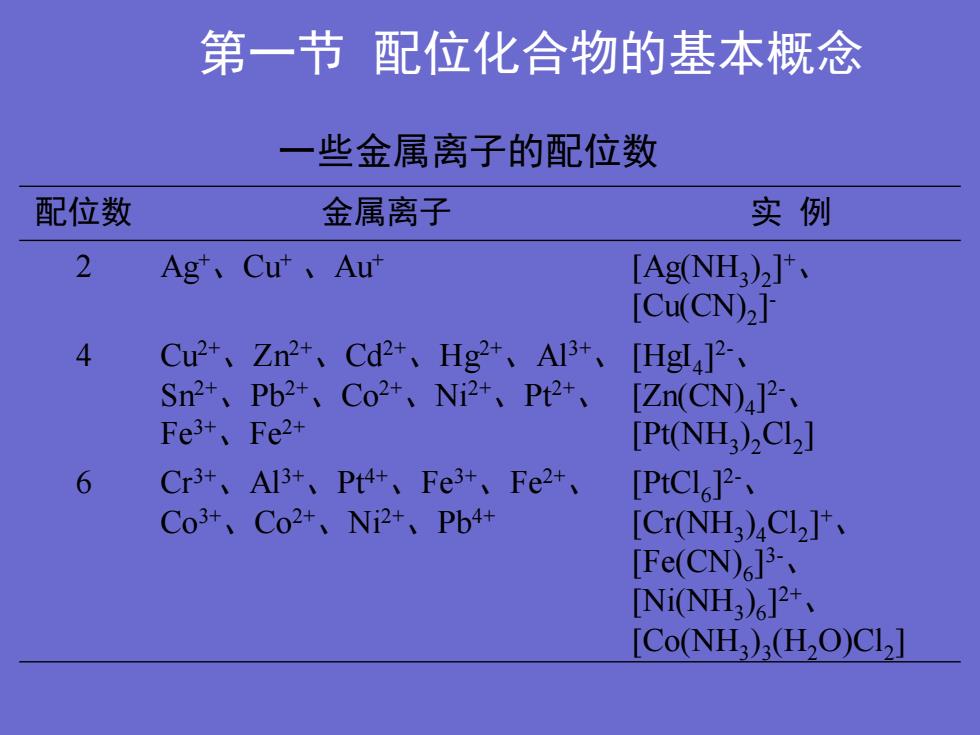
第一节配位化合物的基本概念一些金属离子的配位数实例配位数金属离子2Agt、Cut、Aut[Ag(NH),]+[Cu(CN),]4Cu2+、Zn2+、Cd2+、Hg2+、A13+、[Hgl4]?-、Sn?+、Pb2+、Co2+、Ni2+、Pt2+、[Zn(CN)4]2-、Fe3+、Fe2+[Pt(NH,),Cl2]6Cr3+、A13+、Pt4+、Fe3+、Fe2+、[PtCl,]2-,Co3+、Co2+、Ni2+、Pb4+[Cr(NH3)4C12]+[Fe(CN),]3--[Ni(NH3)]2+[C(NH)(H,O)C]
第一节 配位化合物的基本概念 一些金属离子的配位数 配位数 金属离子 实 例 2 Ag+ 、Cu+ 、Au+ [Ag(NH3 ) 2 ] + 、 [Cu(CN)2 ] - 4 Cu2+ 、Zn2+ 、Cd2+ 、Hg2+ 、Al3+ 、 Sn2+ 、Pb2+ 、Co2+ 、Ni2+ 、Pt2+ 、 Fe3+ 、Fe2+ [HgI4 ] 2-、 [Zn(CN)4 ] 2-、 [Pt(NH3 ) 2Cl2 ] 6 Cr3+ 、Al3+ 、Pt4+ 、Fe3+ 、Fe2+ 、 Co3+ 、Co2+ 、Ni2+ 、Pb4+ [PtCl6 ] 2-、 [Cr(NH3 ) 4Cl2 ] + 、 [Fe(CN)6 ] 3-、 [Ni(NH3 ) 6 ] 2+ 、 [Co(NH3 ) 3 (H2O)Cl2 ]

第一节配位化合物的基本概念配离子的电荷5.酉配离子的电荷数等于中心原子和配体总电荷的代数和:例1.[Cu(NH3)4]2+配离子电荷数=1×(+2)+4×0=+2。例2.[Hgl4]2-配离子的电荷数=1×(+2)+4×(-1)=-2。外层离子的电荷总数和配离子的电荷总数相等而符号相反,所以由外层离子的电荷可以推断出配离子的电荷及中心原子的氧化值
第一节 配位化合物的基本概念 5. 配离子的电荷 • 配离子的电荷数等于中心原子和配体总电荷的 代数和: 例1. [Cu(NH3 )4 ] 2+ 配离子电荷数=1×(+2)+4×0=+2。 例2. [HgI4 ] 2- 配离子的电荷数=1×(+2)+4×(-1)=-2。 • 外层离子的电荷总数和配离子的电荷总数相等, 而符号相反,所以由外层离子的电荷可以推断 出配离子的电荷及中心原子的氧化值

第一节配位化合物的基本概念三,酒配合物的命名1.酒配位化合物的命名:阴离子在前、阳离子在后配阳离子:“某化某”、“氢氧化某”、“某酸某”[Fe(en)3]Cl3、[Ag(NH3)2]OH、[Cu(NH3)4]SO4配阴离子:“某酸”、“某酸某”H2[PtCl6]NH4[Co(NH2)4(NH3)2]
第一节 配位化合物的基本概念 三. 配合物的命名 1. 配位化合物的命名:阴离子在前、阳离子在后 • 配阳离子: “某化某”、 “氢氧化某”、“某酸某” [Fe(en)3 ]Cl3、[Ag(NH3 )2 ]OH、[Cu(NH3 )4 ]SO4 • 配阴离子: “某酸”、 “某酸某” H2 [PtCl6 ]、NH4 [Co(NH2 )4 (NH3 )2 ]