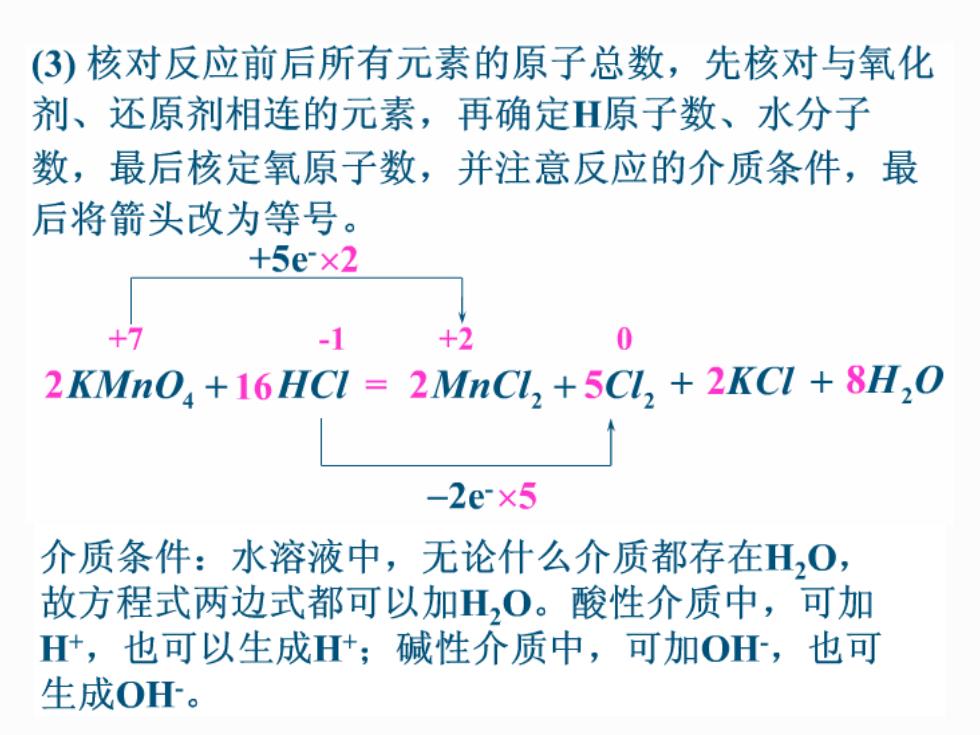
(3)核对反应前后所有元素的原子总数,先核对与氧化 剂、还原剂相连的元素,再确定H原子数、水分子 数,最后核定氧原子数,并注意反应的介质条件,最 后将箭头改为等号。 +5e×2 +7 -1 +2 0 2KMnO +16HCI 2MnCL,+5CL,+2KCI 8H,0 -2e×5 介质条件:水溶液中,无论什么介质都存在H,0, 故方程式两边式都可以加H,0。酸性介质中,可加 H,也可以生成H;碱性介质中,可加O,也可 生成OH
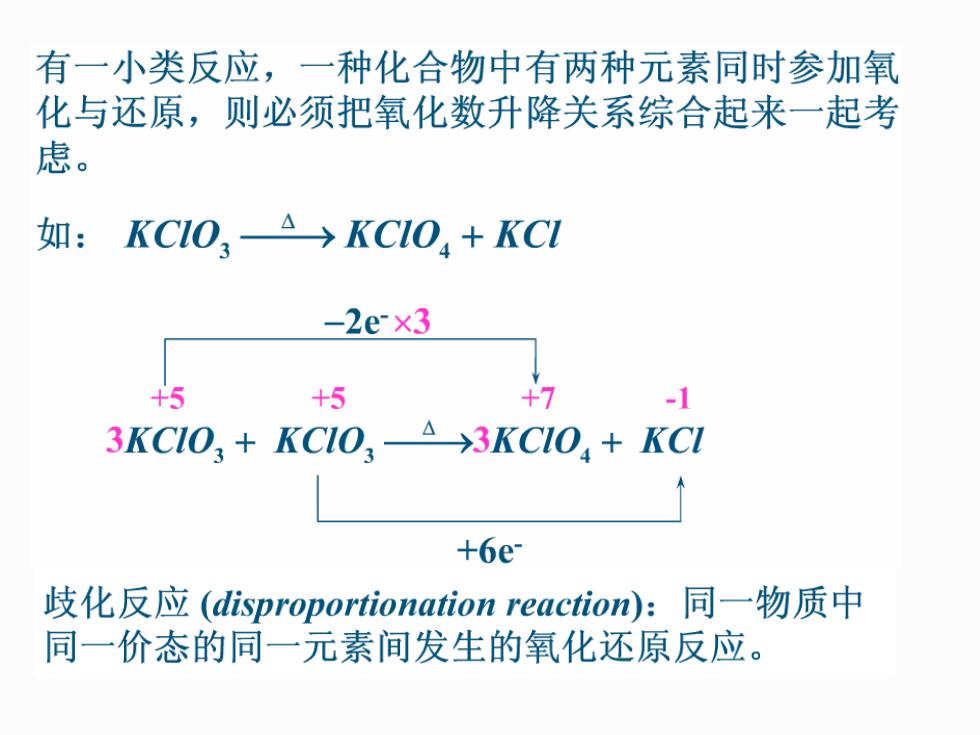
有一小类反应,一种化合物中有两种元素同时参加氧 化与还原,则必须把氧化数升降关系综合起来一起考 虑。 如: KC1OA→KC1O,+KC1 -2e×3 +5 +5 +7 -1 3KCIO,+KCIO,-A3KCIO+KCI +6e 歧化反应(disproportionation reaction):同一物质中 同一价态的同一元素间发生的氧化还原反应
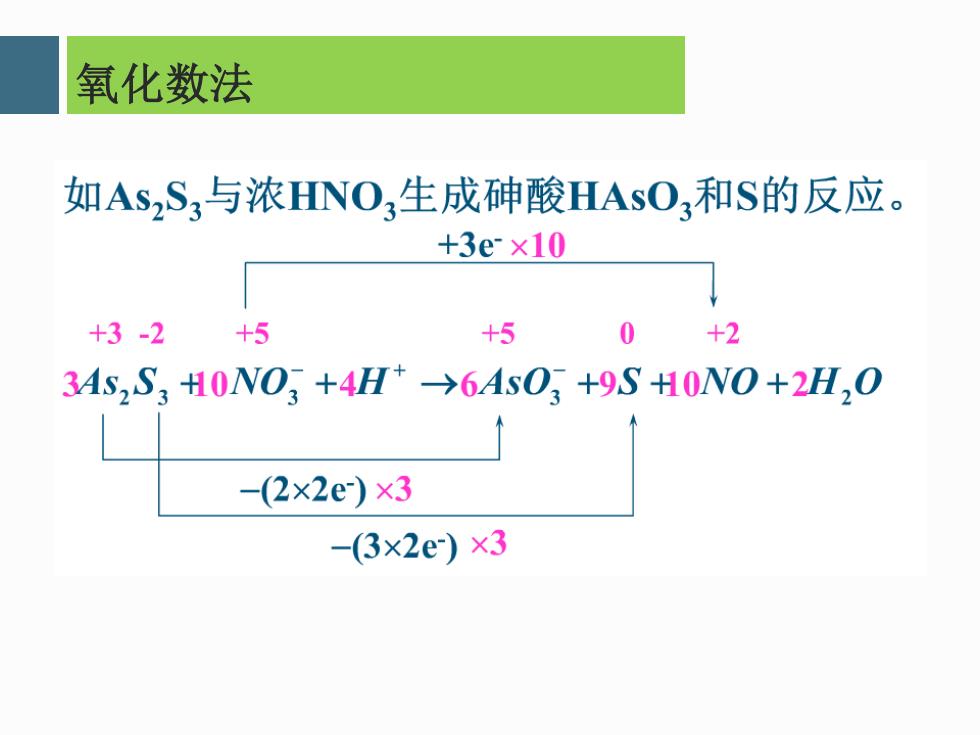
氧化数法 如AsS,与浓HNO,生成砷酸HAsO3和S的反应。 +3e×10 +3-2 +5 +5 0 +2 34S,S,H0N0+4H+→6As03+9SH0N0+2H,0 -(2x2e)x3 -(3x2e)×3
氧化数法 ⚫ 例

2.半反应法(离子电子法) >基本依据:在离子方程式两边,氧化剂得到的 电子总数与还原剂失去的电子总数相等,且反 应前后总的电荷数不发生变化。 KMnO FeSO>Mn2++Fe3+ (1)分别写出氧化和还原的半反应。或根据电极电势 表查出氧化剂KMnO,和还原剂Fe+的相应电对: Ox: Fe2+→Fe3+ Red:MnO,→Mn2+
2.半反应法(离子-电子法) ⚫ 例

(2)分别对氧化、还原半反应进行物料配平。用 H,O去配平氧元素,用H去配平氢元素。 Mn0,+8H+-→Mn2++4H,0 Fe2+→Fe3+ (3)在氧化、还原半反应两边加上电子进行电荷配 平,并乘以适当的系数使两个半反应获得电子数和失 去电子数相等。 Mn0,+8H+5e→Mm2++4H,0 5Fe2+→5Fe3++5e (4)将两个半反应加合成一个离子方程式,并消去两边 的电子。 Mn0+8Ht+5Fe2+-→Mn2++5Fe3++4H,0