
★ 平衡状态是两种相反趋势导致的折中状态 两种相反趋势是指系统总是趋向最低能量的趋势 和趋向最大混乱度的趋势。CaCO3中的C原子和O原子 高度有序,由其形成的C0钻据着晶格中的确定位置。 分解反应相应于将C0C0,气体分子形式游离出来 游离出来的气体分子能运动于反应容器的整个空间。 与C0钟禁锢的C02相比,气态C02分子的混乱度更高 如果只有熵变这一因素,CaCO3将会完全分解。然而 CaCO3的分解为吸热过程,熵变有利的这一反应焓变 却不利。逆反应的情况恰好颠倒过来:熵变不利而焓变 却有利。可以认为,平衡系统中CO,的分压反映了两 种趋势导致的折中状态
★ 平衡状态是两种相反趋势导致的折中状态 两种相反趋势是指系统总是趋向最低能量的趋势 和趋向最大混乱度的趋势。CaCO3中的C原子和O原子 高度有序,由其形成的 占据着晶格中的确定位置。 分解反应相应于将 以CO2气体分子形式游离出来, 游离出来的气体分子能运动于反应容器的整个空间。 与 中禁锢的CO2相比,气态CO2分子的混乱度更高。 如果只有熵变这一因素,CaCO3将会完全分解。然而 CaCO3的分解为吸热过程,熵变有利的这一反应焓变 却不利。逆反应的情况恰好颠倒过来: 熵变不利而焓变 却有利。可以认为,平衡系统中CO2的分压反映了两 种趋势导致的折中状态。 2- CO3 2- CO3 2- CO3

平衡常数 浓度平衡常数Kc 压力平衡常数Kp
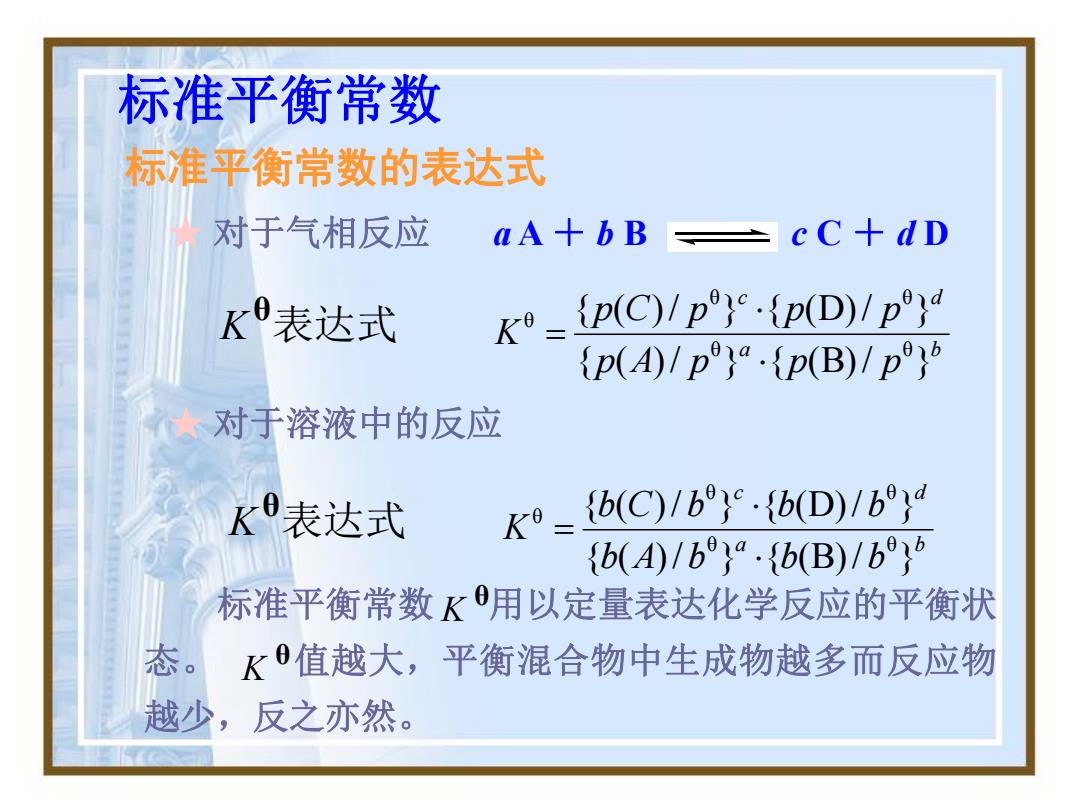
标准平衡常数 标准平衡常数的表达式 对于气相反应 aA+bB ÷cC+dD K表达式 {p(C)1p}{pD)1p} p(A)Ipp(B)/p ★对于溶液中的反应 K9表达式 K9= {b(C)/b}.{b(D)/b,d {b()/b}·{b(B)/b}6 标准平衡常数K用以定量表达化学反应的平衡状 态。 K值越大,平衡混合物中生成物越多而反应物 越少,反之亦然
标准平衡常数 标准平衡常数的表达式 ★ 对于溶液中的反应 K θ表达式 a b c d b A b b b b C b b b K { ( )/ } { (B)/ } { ( )/ } { (D)/ } θ θ θ θ θ 标准平衡常数 用以定量表达化学反应的平衡状 态。 值越大,平衡混合物中生成物越多而反应物 越少,反之亦然。 θ K θ K K θ表达式 a b c d p A p p p p C p p p K { ( )/ } { (B)/ } { ( )/ } { (D)/ } θ θ θ θ θ ★ 对于气相反应 a A + b B c C + d D

对通式 aA(s)+bB(aq) ±cC(aq+dD(g) 所表示的多相反应而言,K0的表达式则为 K0 b(C)/bc.ip(D)pa (b(B)/6) △K是无量纲的量 ▲K是温度的函数,与浓度、分压无关 ▲标准平衡常数表达式必须与化学反应计量式相对应
b c d b b b b p p K { ( )/ } { ( )/ } { ( ) } B θ C D ★ 对通式 ▲ 是无量纲的量 ▲ 是温度的函数,与浓度、分压无关 ▲ 标准平衡常数表达式必须与化学反应计量式相对应 θ K θ K 所表示的多相反应而言, K θ 的表达式则为 a A(s) + b B(aq) c C(aq) + d D(g)

Ques 已知25℃时反应 (1) 2BrCI(g)=Cl2(g)+Br2(g)=0.45 (2)2(g+Br2(g)=2IBr(g)的K9=0.051 计算反应(3)2CIBr(g)+,(g)一2IBr(g)+Cl,(g)的Kg Solution 反应(1)+(2)得: 2CIBr(g)+I2(g)-2IBr(g)+Cl2(g) Kg=K9·K =0.45×0.051 =0.023
已知25℃时反应 (1)2BrCl(g) Cl2(g) + Br2(g) 的 (2)I2(g)+Br2(g) 2IBr(g) 的 计算反应(3)2ClBr(g) + I2(g) 2IBr(g)+ Cl2(g)的 θ K3 0 45 θ 1 K . 0 051 θ 2 K . Question 2ClBr(g) + I2(g) 2IBr(g) + Cl2(g) 0 023 0 45 0 051 θ 2 θ 1 θ 3 . . . K K K Solution 反应(1)+ (2)得: