
啊计凳 反应的△G或△G0? 1.通过公式 △G0=△H0-TAS9 2 通过公式 4, = ∑jArGm(产物)-∑ArG(反应物) 3.如果能根据盖斯定律由一组已知反应方程式通过加 加减减的办法得出所要研究的那个反应方程式, 就可根据已知反应的△GA值,通过加加减减的办法 得出所要研究的那个反应的△G日值
反应的G或G θ? 1. 通过公式 θ θ θ G H TS 2. 通过公式 (产物) (反应物 ) θ i f m θ j f m θ r m v G v G G 3. 如果能根据盖斯定律由一组已知反应方程式通过加 加减减的办法得出所要研究的那个反应方程式, 就可根据已知反应的 值, 通过加加减减的办法 得出所要研究的那个反应的 值 。 θ fGm θ fGm

Gibbsi函数的应用 1.判断反应进行的方向和限度 2. 判断物质的稳定性Gibbs函数越大的系 统,稳定性越小,故可用化合物的标准 生成Gibbsi函数变的数值和符号来比较他 们稳定性大小。 3.7 估算反应进行的温度 4. 设计耦合反应如果一个反应等于两个或 两个以上反应的反应之和(或差),则 该反应的Gibbs函数变应等于各分反应的 Gibbs函数变之和(或差)

平衡衡状态和标准平衡衡常数 Equilibrium and standard equilibrium constant 平衡状态 Equilibrium state 标准平衡常数 Standard equilibrium constant 平衡移动 Shift of the equilibrium
平衡移动 Shift of the equilibrium 平衡状态 Equilibrium state 标准平衡常数 Standard equilibrium constant 平衡状态和标准平衡常数 Equilibrium and standard equilibrium constant
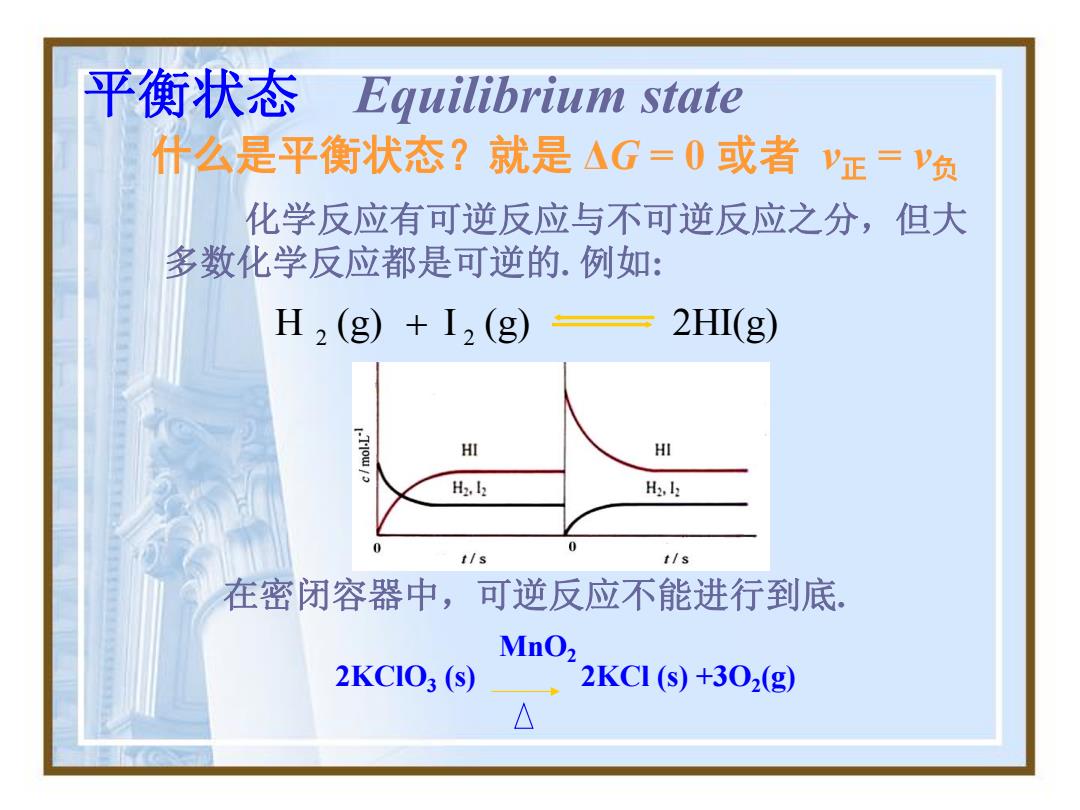
平衡状态Equilibrium state 什么是平衡状态?就是AG=0或者y正='负 化学反应有可逆反应与不可逆反应之分,但大 多数化学反应都是可逆的.例如: H2(g)+I2(g) 2H(g) HI HI H22 H2,l: 0 0 t/s t/s 在密闭容器中,可逆反应不能进行到底。 MnO2 2KCIO;(s) 2KC1(S)+302(g) △
平衡状态 Equilibrium state 什么是平衡状态?就是 ΔG = 0 或者 v正 = v负 在密闭容器中,可逆反应不能进行到底. H (g) I (g) 2HI(g) 2 2 化学反应有可逆反应与不可逆反应之分,但大 多数化学反应都是可逆的. 例如: MnO2 2KClO3 (s) 2KCl (s) +3O2(g)

化学平衡的鲜明特点 ★平衡是动态的 系统各组分无限期保持恒定并不意味着正、逆反应 的终止,只不过朝两个方向进行的速率相等而已。如反 应 CaCO3(s) CaO(s)+CO,(g) 平衡时,CaC0,仍在不断分解为Ca0和C02,Ca0与C0 仍在不断形成CaC03(用放射性同位素14C标记法)。 到达平衡状态的途径是双向的 对上述反应,不论从哪个方向都能到达同一平衡状 态。温度一经确定,CO,的平衡压力也就确定,在该压 力下产生C0,的速率等于它转化为CaC03的速率
化学平衡的鲜明特点 ★ 平衡是动态的 ★ 到达平衡状态的途径是双向的 对上述反应,不论从哪个方向都能到达同一平衡状 态。温度一经确定,CO2的平衡压力也就确定,在该压 力下产生CO2的速率等于它转化为CaCO3的速率。 系统各组分无限期保持恒定并不意味着正、逆反应 的终止,只不过朝两个方向进行的速率相等而已。如反 应 CaCO3(s) CaO(s) + CO2(g) 平衡时,CaCO3仍在不断分解为CaO和CO2 , CaO与CO2 仍在不断形成CaCO3(用放射性同位素14C标记法)