
第二章热力学第一定律 31 △m=1-1.5=-0.5,△H<U △和△H的差别主要是由反应前后气态物质的物质的量不同而引起的。如果反应前后气态 物质的物质的量相同,即△n=0,则△H=△W;如果不相同,当△n<0时△H<△,当△>0时△H> △U. 27.0.500g正庚烷放在弹式量热计中,燃烧后温度升高2.94K,若量热计本身及其附件的热 容量为8.177k·K,计算298K时正庚烷的摩尔燃烧焙(量热计的平均温度为298K). 解正庚烷的燃烧反应为 C,H()+11O(g)-7C0(g)+8H,01) 0.500g正庚烷燃烧反应的反应进度 4=餐-M年控=1020-499×10m 在弹式量热计中测得的等容燃烧热 A.=是-(品4Jm1=-4818x10W:mr 正庚烷的摩尔燃烧焙 AHm=AUn十△R7 =[-4.818×103+(7-11)×8.3145×2987J·mol-1=-4.828×103k】·mo1-1 28.根据下列反应在298.15K时的焙变值,计算AgC(s)的标准摩尔生成 H(AgCl,s,298.15 K). (1)Ag0(s)+2HC1(g)-2AgC1(s)+H,0I),4,H品(298.15K)=-324.9kJ·mol-1 (2)2Ag(s)+号0,(g)=一Ag0(s),AH品(298.15K)=-30.57kJ·mol- (3)2H(g)+2Cl,(g)=HC1(g),aH8(298.15K)=-92.31kJ·mol (4)H(g)+0:(g)一H,0),4H品(298.15K)=-285.84kJ·mol-1 解由上述四个反应组合 ()×2+(2)×2+(3)-(4)× 即可得到AgCl(s)的生成反应 Ag(s)+Cl(g)-AgCl(s) 所以 △H9(AgC1,s,2983.15K)=号AH品+号AH9+AH8-号A,H品 =[号×(-324.9)+号×(-30.57)+(-92.31)-号×(-285.84)kJ·mol- =-127.13kJ·mol 29.在298.15K及100kPa压力时,设环丙烷、石壘及氢的燃烧焙4H9(298.15K)分别为 一2092kJ·mol-、一393.8kJ·mol1及-285.84kJ·mol1,若已知丙烯CH(g)的标准摩尔生 成焙△H9=20.50kJ·mol-,试求:(1)环丙烷的标准摩尔生成焙△H9(298.15K);(2)环丙烷 异构化为丙烯的摩尔反应格变值△,H(298.15K)。 解(1)环丙烷的生成反应为3C(石墨)+3H,(g)CH,(g)

·32· 物理化学埔导与习题详解 环丙烷的生成焙即上述生成反应的反应焙 △Hn9=3△H(石题)+3△H号(Hzg)-△H9(C,H,g) =[3×(-393.8)+3×(-285.84)-(-2092)]kJ·mol-t=53.08kJ·mol (2)环丙烷异构化为丙烯的反应为 H,CCH一CH,CHCH CHa 环丙烷异构化为丙烯的反应焙 △,H9=△H9(丙烯)一△H9(环丙烷) =(20.50-53.08)kJ·mol-1=-32.58kJ·mol-1 30.根据以下数据,计算乙酸乙酯的标准摩尔生成H9(CH,CO0CH,l,298.15K)。 CH,C00H1)+CH,OH1)CH,C00CH,)+H,0I),△,H9(298.15K)=-9.20kJ·mol 乙酸和乙醇的标准摩尔燃烧焙4H9(298.15K)分别为一874.54k灯·mol1和-1366 kJ·mol-,C02(g)和H,0(1)的标准摩尔生成焙分别为一393.51k灯·mol1和-285.83 kJ·mol. CH,COOH(I)+CH;OH(1)-CHCOOC:H (1)+HO(1) △,He(298.15K)=△H9(CH,COOH,l)+△He(C,H,OH,l) -AH (CH,COOC:Hs,1)-AH(H:O,1) 乙酸乙酯的标准摩尔燃烧焙为 H(CH,COOC:Hs,D)H (CH,COOH,I)+H(C:H,OH,I) -AH9(H,0,l)-△He(298.15K) =(-874.54-1366+0+9.20)kJ·mo1-1=-2231.34k·mol 乙酸乙酯的燃烧反应为 CH,C00C,H,)+50z(g)4C0z(g)+4H,0) △,He(298.15K)=4aH(C02g)+4△H(HO,l) -A:H(CH,COOC.Hs,I)-5AH (O2,g) 乙酸乙酯的标准摩尔燃烧焙是乙酸乙酯燃烧反应的反应培,即△H9(298.15K) 4He(CH,COOC,H,lD,所以 AH (CH,COOC,Hs,D) =4AH (CO:.g)+4AH(H2O,1)-5AH(O,g)-AH(CH,COOC,H,1) =[4×(-393.51)+4×(-285.83)一0-(-2231.34)]kJ·mol-1 486.02kJ·mol 31.请计算298K和标准压力下,如下反应的标准摩尔焙变△H日(298.15K),这个数值的1/4 称为C一H键的“健焙”(平均值) C(g)+4H(g)CH() 已知:石升华为碳原子的变估计为bH=711.1kJ·mol1,H2(g)一2H(g)的标准解离 △H9=431.7kJ·mol-1:CH,(g)的标准摩尔生成培△H(298.15K)=一74.78kJ·mol-。 解①C(石墨)C(g),bH9=711.1k·mol-1 ②H,(g)2H(g),△H=431.7kJ·mol
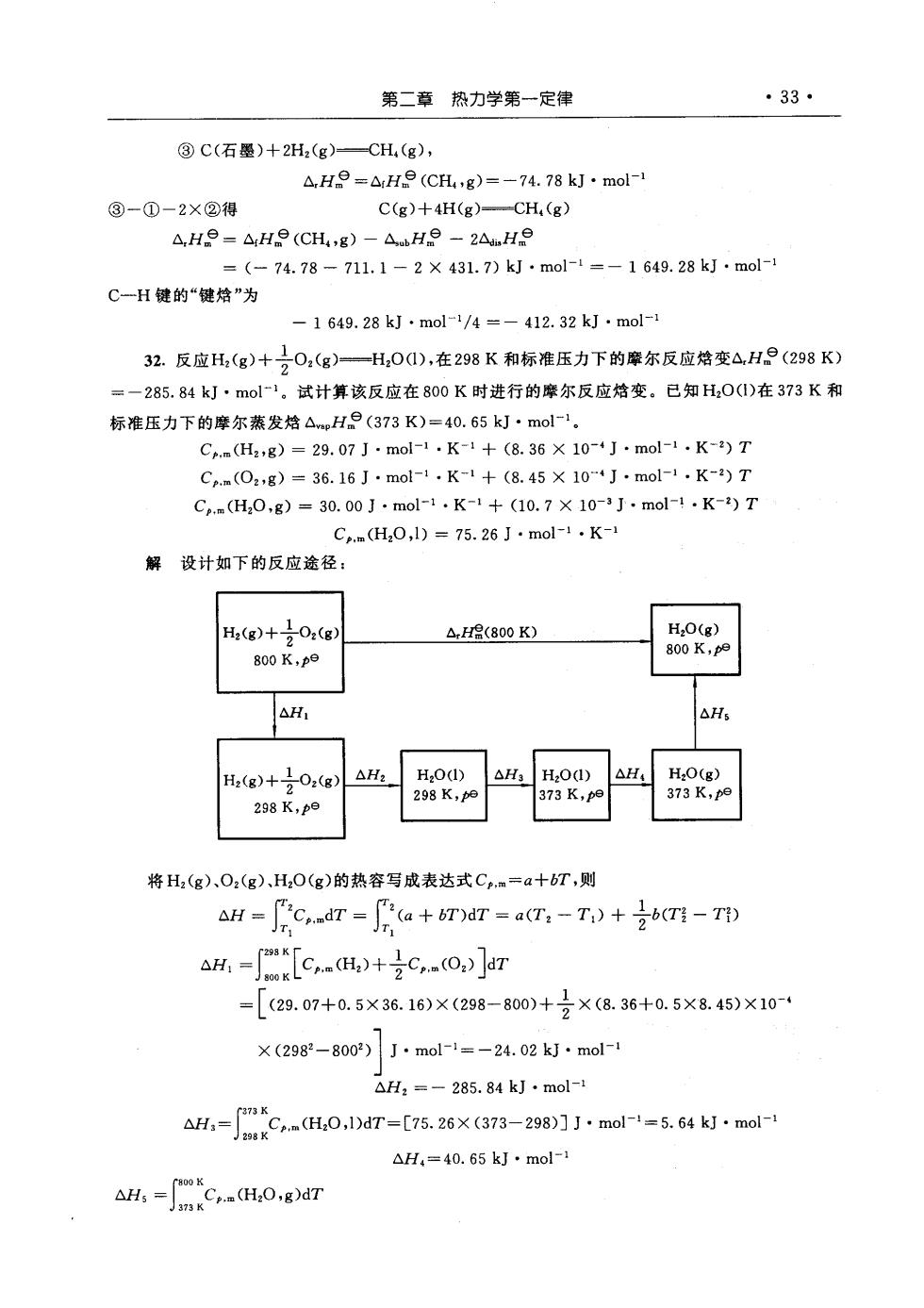
第二章热力学第一定律 ·33· ③C(石墨)+2H,(g)CH,(g), △He=△He(CH,g)=-74.78kJ·mol- ③-①-2×②得 C(g)+4H(g)-CH,(g) A,He=△H9(CH,g)-△bH9-2AnHe =(-74.78-711.1-2×431.7)kJ·mol-1=-1649.28kJ·mol- C一H键的“键焙”为 -1649.28kJ·mol-1/4=-412.32kJ·mol- 32.反应H,(g)+0,(g)一H,0),在298K和标准压力下的摩尔反应格变△HP(298K) =一285.84kJ·mol1。试计算该反应在800K时进行的摩尔反应焙变。已知H,0(I)在373K和 标准压力下的摩尔蒸发焙△H9(373K)=40.65kJ·mol-。 C.m(H,g)=29.07J·mol-1·K-1+(8.36×10-4J·mol-1·K-)T C.(O,g)=36.16J·mol-1·K-1+(8.45×10‘J·mol1·K-2)T C.(H,0,g)=30.00J·mol-1.K-+(10.7×10-3J·mol-1.K-)T C.(H,0,l)=75.26J·mol1·K-1 解设计如下的反应途径: H2(g)+102(g △H8(800K) 800K,p9 △H1 △H H(g)+02(g) △H2 298 K,pe 将H(g).O,(g),H,0(g)的热容写成表达式Cp,m=a十bT,则 AH =C,dT =(a BT)dT a(T:-T:)+b(TI-T1) [Ct+c =[(29.07+0.5×36.16)×(298-800)+×(8.36+0.5×8.45)×10- ×(2982-8002)J·mol-1=-24.02k·mol- △H2=-285.84kJ·mol-1 △H=mC(H0,1Dar=[75.26×(373-2980]mol-=5.64·molr △H,=40.65kJ·mol C

·34· 物理化学辅导与习题详解 =30.00×(800-373)+号×10.7×103×(802-3732)]J·mol-1=15.49k灯·mol 反应在800K时的摩尔反应结变 ,H2(800K)=△H1+△H2+△H,+△H+△Hs=-248.08kJ·mol-1 33.某高压容器中含有未知气体,可能是氮气或氩气。今在298K时,取出一些样品,从5dm3 绝热可逆膨胀到6dm3,温度降低了21K,试判断容器中是何气体。设振动的贡献可忽略不计 解设气体为理想气体。绝热可逆过程方程式 TV-=TV y-哥8+1-28a/2+1=10 1n(5/6) 又因为 所以 2=140,G=2R 根据能量均分原理,单原子分子只有3个平动自由度,其热容为号R:双原子分子在不考虑振动自 由度时,有3个平动自由度和2个转动自由度,其热容为号R。所以该未知气体是氮气。 34.将H,0看做是刚体非线性分子,用经典理论来估计其气体的C,m(H,0,g)值。(1)在温度 不太高时,忽略振动自由度项的贡献;(2)在温度很高时,将所有的振动贡献都考虑进去。 解(1)H0是三原子非线性分子,在常温时(不考虑振动自由度),有3个平动自由度和3个 转动自由度,每个自由度对能量的贡献为号T,所以 U=之kTX6XL=3RT C.Cv.m+R=4R 33.26 J.mol-1.K-1 (2)在高温时,还要考虑(3×3一6)个振动自由度,每个振动自由度有2个平方项,对能量的贡 献为T,所以 U.=(子TX6+T×3×L=6RT C=(),=6R C.m=Cv.+R=7R=58.20J.mol-1.K-1 35.在环境温度为298K、压力为100kPa的条件下,用乙炔与压缩空气混合,燃烧后用来切割 金属,试粗略计算这种火焰可能达到的最高温度,设空气中氧的含量为20%,已知298K时的热力 学数据如下: 物质 △He/k·mol-)Cp.a/J·mol-·K) C02(g) -393.51 37.1 H:O(g) -241.82 33.58 C2H2(g)226.7 43.93 N,(g) 0 29.12
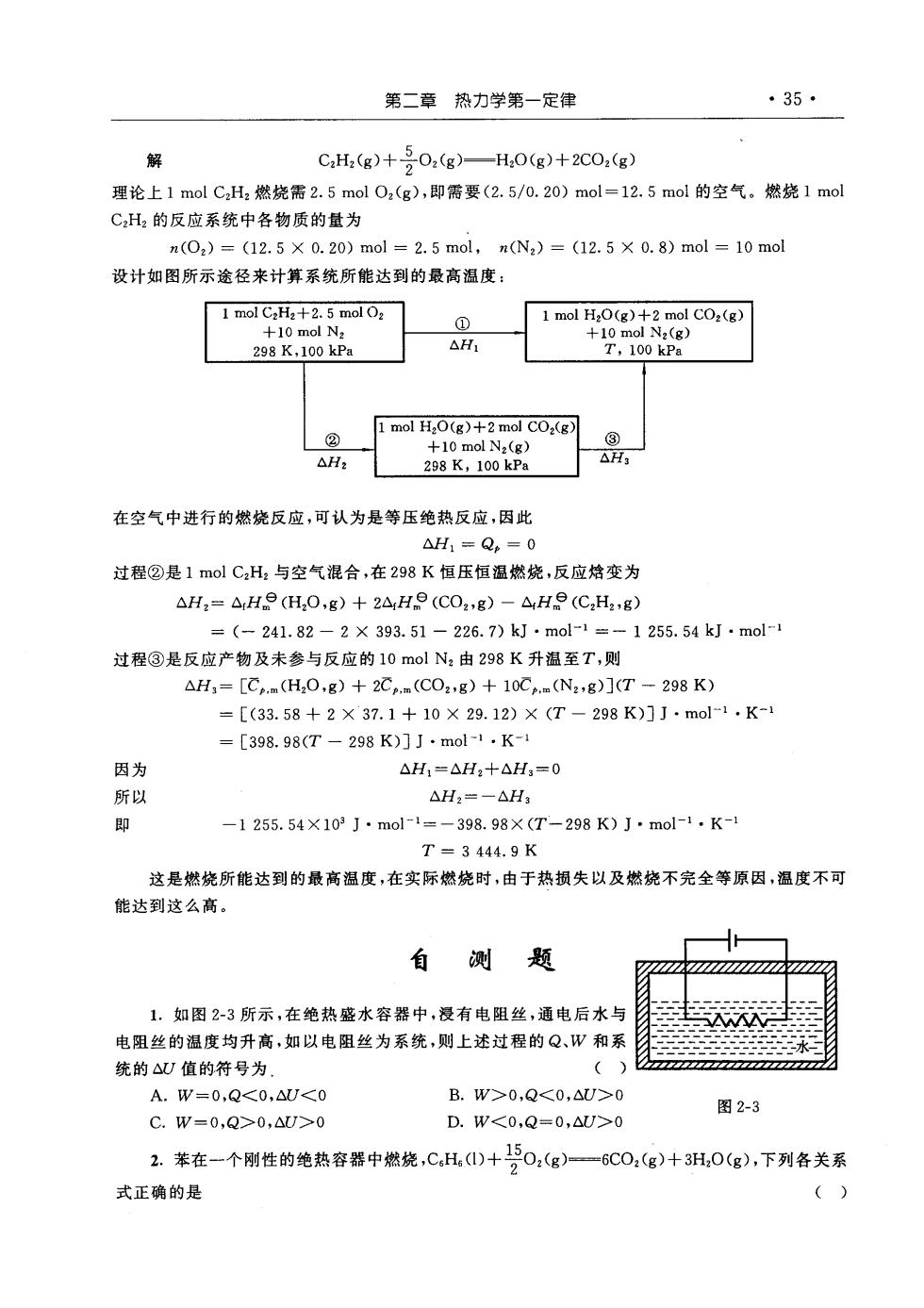
第二章热力学第一定律 ·35· 解 CH,(g)+号02(g)—H,0(g)+2C02(g) 理论上1molC,H2燃烧需2.5mol02(g),即需要(2.5/0.20)mol=12.5mol的空气。燃烧1mol C,H的反应系统中各物质的量为 u(0。)=(12.5×0.20)mol=2.5mol,n(N,)=(12.5×0.8)mol=10mol 设计如图所示途径来计算系统所能达到的最高温度: 1 mol C2H2+2.5 mol O2 ① 1 mol HaO(g)+2 mol COa (g) 29R100 △H +10 mol COx(g) △H2 298K,100kPa AH: 在空气中进行的燃烧反应,可认为是等压绝热反应,因此 △H:=Qe=0 过程②是1mo1C,H,与空气混合,在298K恒压恒温燃烧,反应培变为 △H2=△He(H,O,g)+2△rHe(CO2,g)-△He(CH2,g) =(-241.82-2×393.51-226.7)kJ·mol-1=-1255.54kJ·mol-1 过程③是反应产物及未参与反应的10molN由298K升温至T,则 △H1=[C.(H20,g)+2C.m(CO2,g)+10C.m(N2,g)](T-298K) =[(33.58+2×37.1+10×29.12)×(T-298K)]J·mo-1·K- =[398.98(T-298K)]J·mol-1·K-1 因为 △H1=△H2+△H3=0 所以 △H2=-△H3 ⑧ -1255.54×103J·mol-1=-398.98×(T-298K)J·mol-1.K-1 T=3444.9K 这是燃烧所能达到的最高温度,在实际燃烧时,由于热损失以及燃烧不完全等原因,温度不可 能达到这么高。 测 题 1.如图2-3所示,在绝热盛水容器中,浸有电阻丝,通电后水与 电阻丝的温度均升高,如以电阻丝为系统,则上述过程的Q、W和系 统的△)值的符号为 】 A.W=0,Q<0,△U<0 B.w>0,Q<0,△U>0 C.w=0,Q>0,△>0 图2-3 D.W<0,Q=0,△U>0 2.苯在一个刚性的绝热容器中燃烧,C,H()+0,(g)=6C0,(g)十3H,0(g),下列各关系 式正确的是 ()