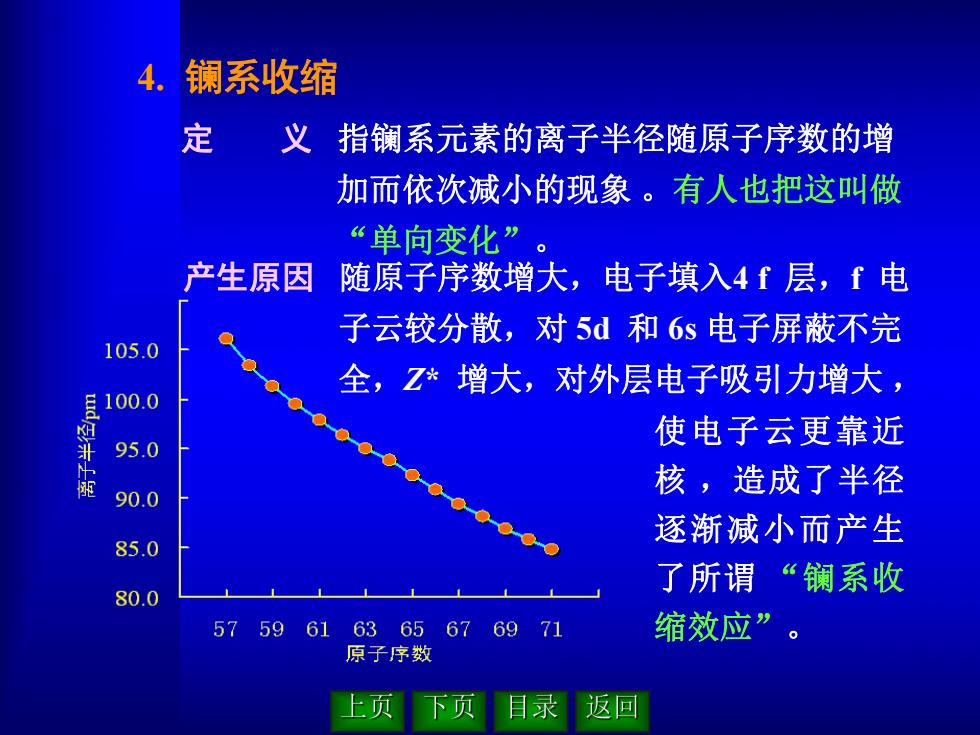
4. 镧系收缩 定义指镧系元素的离子半径随原子序数的增 加而依次减小的现象。有人也把这叫做 “单向变化”。 产生原因 随原子序数增大,电子填入4f层,f电 子云较分散,对5d和6s电子屏蔽不完 105.0 全,Z*增大,对外层电子吸引力增大 100.0 使电子云更靠近 95.0 核,造成了半径 90.0 逐渐减小而产生 85.0 了所谓“镧系收 80.0 5759616365676971 缩效应”。 原子序数 上页 下页 目录 返回
4. 镧系收缩 定 义 指镧系元素的离子半径随原子序数的增 加而依次减小的现象 。有人也把这叫做 “单向变化” 。 产生原因 随原子序数增大,电子填入4 f 层,f 电 子云较分散,对 5d 和 6s 电子屏蔽不完 全,Z* 增大,对外层电子吸引力增大 , 使电子云更靠近 核 ,造成了半径 逐渐减小而产生 了所谓 “镧系收 缩效应”

系收缩产生的影响 Lanthanide contraction 收缩缓慢是指相邻两个元素而言,两两之间的减小 幅度不如其他过渡元素两两之间的减小幅度大,使 镧系元素内部性质太相似,增加了分离困难; 使镧系元素后的第三过渡系的离子半径接近于第二 过渡系同族,如Zr4+(80pm)和Hf+(81pm),Nb+ (70pm)和Ta5+(73pm,Mo6+(62pm)和W+(65 pm),化学性质相似,矿物中共生,分离困难; ●使Y的原子半径处于Ho和E之间,其化学性质 与镧系元素非常相似,在矿物中共生,分离困难, 故在稀土元素分离中将其归于重稀土一组。 上页下页目录返回
● 使 Y 的原子半径处于 Ho 和 Er 之间,其化学性质 与镧系元素非常相似,在矿物中共生,分离困难, 故在稀土元素分离中将其归于重稀土一组。 ● 收缩缓慢是指相邻两个元素而言,两两之间的减小 幅度不如其他过渡元素两两之间的减小幅度大,使 镧系元素内部性质太相似,增加了分离困难 ; ● 使镧系元素后的第三过渡系的离子半径接近于第二 过渡系同族,如 Zr 4+(80 pm) 和 Hf 4+ (81 pm), Nb5+ (70 pm) 和 Ta5+ (73 pm),Mo6+ (62 pm) 和 W6+ (65 pm), 化学性质相似,矿物中共生,分离困难;

Que 为什么在镧系中离子半径会出现 单向变化呢?为什么在Gd处出现一种 不连续性呢? Solution 由于镧系元素三价离子的外围电子很有规律(离子 结构为f0至f14),因此离子半径会出现“单向变化” 镧系元素三价离子半径的变化中,在Gd处出现了 微小的可以察觉的不连续性,原因是G3+离子具有半 充满的47电子结构,屏蔽能力略有增加,有效核电荷 略有减小,所以Gd3+离子半径的减小要略微小些,这 叫“钆断效应” 上页 返回
为什么在镧系中离子半径会出现 单向变化呢?为什么在 Gd 处出现一种 不连续性呢? 由于镧系元素三价离子的外围电子很有规律(离子 结构为 f 0 至 f 14 ),因此离子半径会出现“单向变化” 。 镧系元素三价离子半径的变化中,在 Gd 处出现了 微小的可以察觉的不连续性,原因是 Gd3+ 离子具有半 充满的 4 f 7电子结构 ,屏蔽能力略有增加,有效核电荷 略有减小,所以 Gd3+ 离子半径的减小要略微小些,这 叫 “钆断效应” 。 Question 1 Solution

Que 为什么原子半径图中Eu和 Yb出现峰值? Solution 镧系原子4f电子受核束缚,只有5d和6s电子才能 成为自由电子,RE(g)有3个电子(5d16s2)参与形成金 属键,而Eu(g)和 210.0 205.0 Yb(g)只有2个电 200.0 195.0 子(6s2)参与,自 190.0 185 然金属键弱些,显 18转0 173.0 得半径大些。有 170.0 165.0 人也把这叫做 160.0 55 57 59 61 63656769 71 “双峰效应”. 原子序数 上页 下页 目录 返回
为什么原子半径图中 Eu 和 Yb 出现峰值? Question 2 Solution 镧系原子4f 电子受核束缚,只有 5d 和 6s 电子才能 成为自由电子,RE (g) 有 3 个电子 (5d1 6s 2) 参与形成金 属键,而 Eu(g) 和 Yb (g) 只有2个电 子 (6s 2) 参与,自 然金属键弱些, 显 得半径大些 。 有 人 也 把 这叫做 “双峰效应
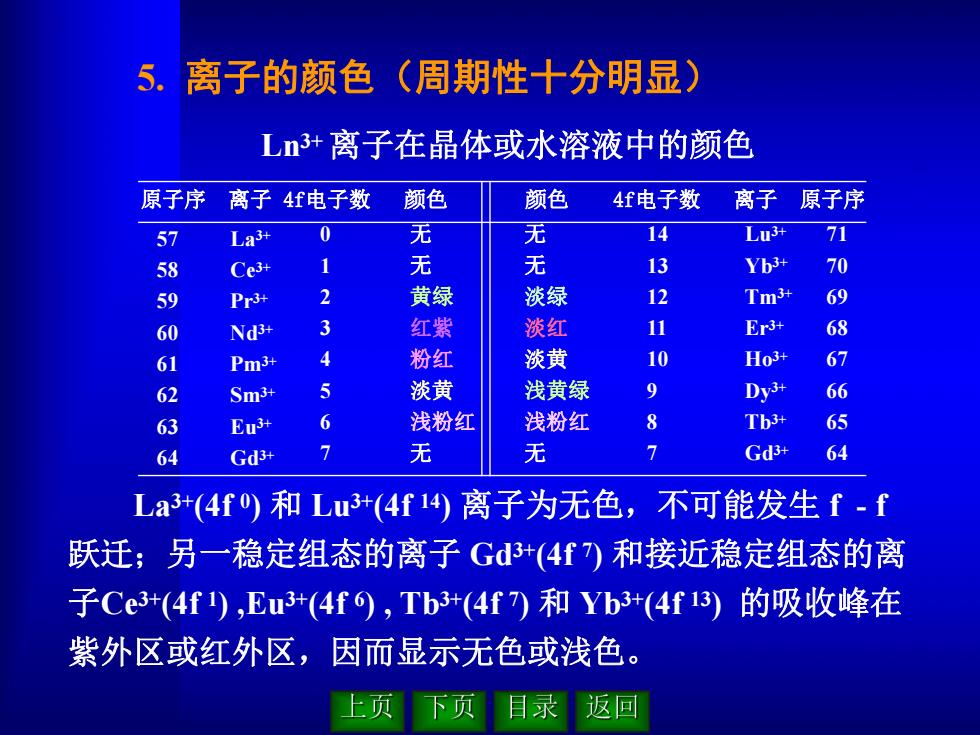
5. 离子的颜色(周期性十分明显) L3+离子在晶体或水溶液中的颜色 原子序 离子4f电子数 颜色 颜色 4f电子数 离子原子序 57 La3+ 0 无 无 14 L3升 71 58 Ce3+ 无 13 Yb3+ 70 59 Pr3+ 2 黄绿 淡绿 12 Tm3+ 69 60 Nd3+ 3 红紫 淡红 11 Er3+ 68 61 Pm3+ 4 粉红 淡黄 10 Ho3+ 67 62 Sm3+ 5 淡黄 浅黄绿 9 Dy3+ 66 63 Eu3+ 6 浅粉红 浅粉红 8 Tb3+ 65 64 Gd3+ 无 无 Gd3+ 64 Lat(4f0)和Lut(4f14离子为无色,不可能发生f-f 跃迁;另一稳定组态的离子Gd+(4f)和接近稳定组态的离 子Ce3+(4f),Eu(4f6),Tb3+(4f7)和Yb3(4f13)的吸收峰在 紫外区或红外区,因而显示无色或浅色。 上页 下页 目录 返回
5. 离子的颜色(周期性十分明显) Ln3+离子在晶体或水溶液中的颜色 原子序 离子 4f电子数 颜色 颜色 4f电子数 离子 原子序 57 58 59 60 61 62 63 64 La 3+ Ce 3+ Pr 3+ Nd3+ Pm3+ Sm3+ Eu3+ Gd3+ 0 1 2 3 4 5 6 7 无 无 黄绿 红紫 粉红 淡黄 浅粉红 无 无 无 淡绿 淡红 淡黄 浅黄绿 浅粉红 无 14 13 12 11 10 9 8 7 Lu3+ Yb3+ Tm3+ Er 3+ Ho 3+ Dy 3+ Tb3+ Gd3+ 71 70 69 68 67 66 65 64 La 3+(4f 0) 和 Lu3+(4f 14) 离子为无色,不可能发生 f - f 跃迁;另一稳定组态的离子 Gd3+(4f 7) 和接近稳定组态的离 子Ce 3+(4f 1) ,Eu3+(4f 6) , Tb3+(4f 7) 和 Yb3+(4f 13) 的吸收峰在 紫外区或红外区,因而显示无色或浅色