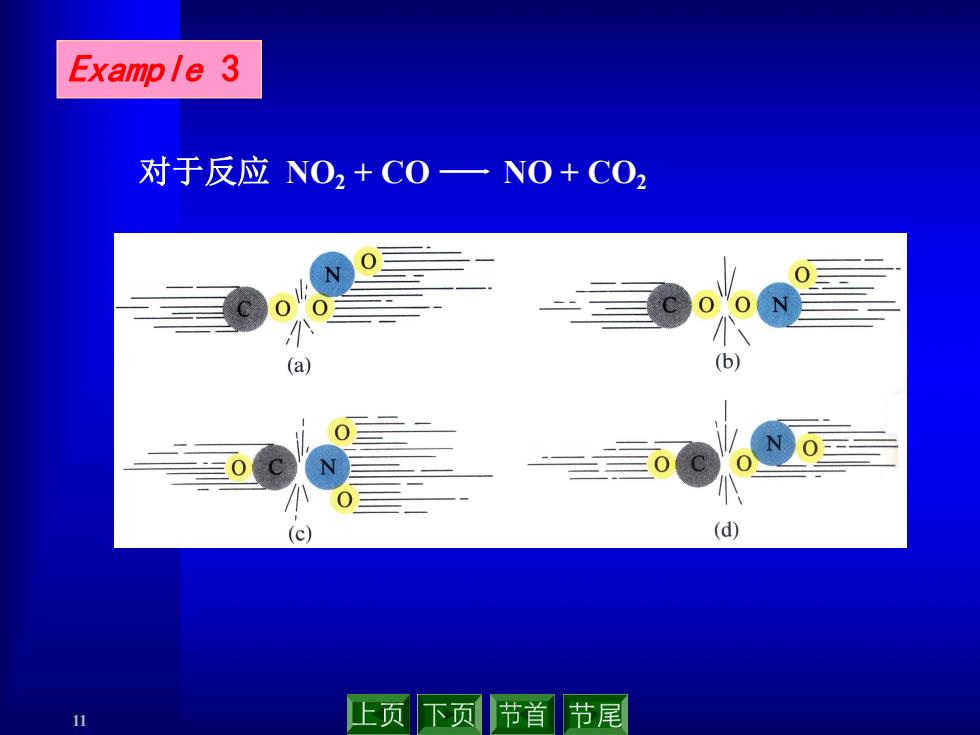
Example 3 对于反应NO2+C0一NO+CO2 (a) (d) 11 止页下页节首节尾
11 Example 3 对于反应 NO2 + CO NO + CO2
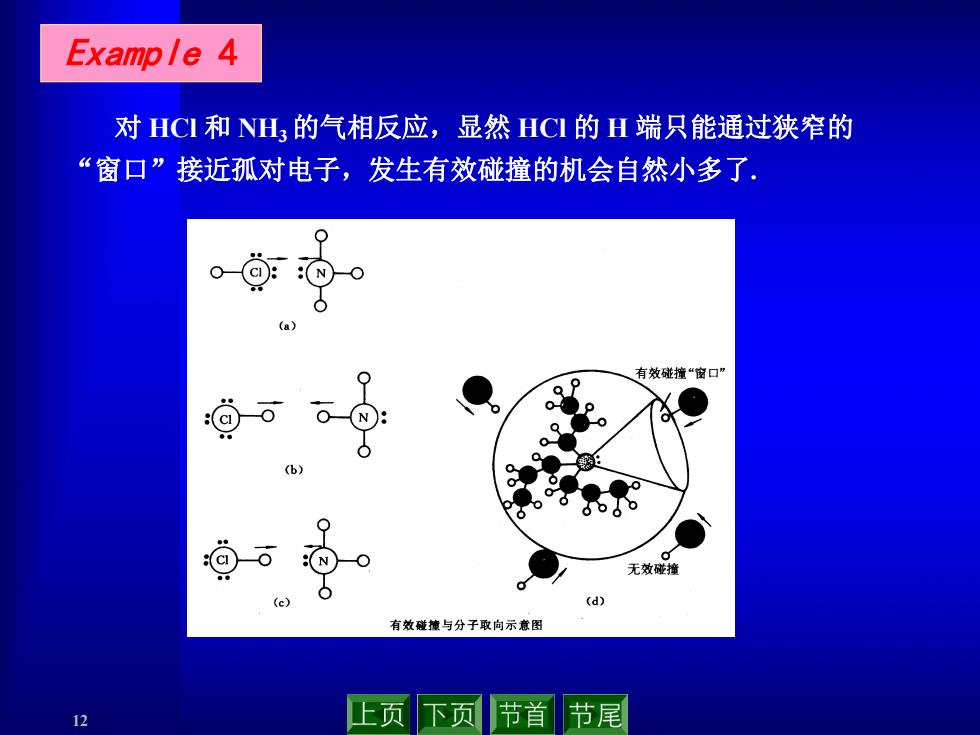
Example 4 对HCI和NH3的气相反应,显然HCI的H端只能通过狭窄的 “窗口”接近孤对电子,发生有效碰撞的机会自然小多了 ● N (a) 有效碰撞“窗口” 回。 Q p 6-⊙ (b) 9 :NO 无效碰撞 b (d) 有效碰罐与分子取向示意图 12 页 下页 节首 节尾
12 Example 4 对 HCl 和 NH3的气相反应,显然 HCl 的 H 端只能通过狭窄的 “窗口”接近孤对电子,发生有效碰撞的机会自然小多了

Example 5 H H H Two HI molecules Transition state Hydrogen molecule lodine molecule 对应2HΠ二H2+2I,若每次碰撞都反应,T=500℃,cH川=1.0×103 mol·dm,d(H)=4.0×1010m.则理论碰撞次数和实际碰撞次数各为多少? Ea v=ZPf=ZPe 这里,Z一 碰撞总数,P一取向因子,f一 能量因子 以碰撞频率公式计算: Z=2N'd2 RT M =4.6×1028次.dm.s 则 v=7.6×10 mol.dm1.sl 实际反应速率仅为1.2×10-8 mol-dm1s-1两者相差1012倍 上页下页节首节尾
13 对应2HI H2+2I,若每次碰撞都反应,T=500℃,c (HI) = 1.0×10-3 mol ·dm-1 , d (HI) = 4.0×10-10m. 则理论碰撞次数和实际碰撞次数各为多少? Example 5 RT Ea Z P f Z P e 以碰撞频率公式计算: 则 实际反应速率仅为1.2×10-8 mol·dm-1 ·s -1 两者相差1012倍 28 1 1 2 2 4.6 10 dm s 2 次 M RT Z N d 4 1 1 7.6 10 mol dm s 这里,Z 碰撞总数, P 取向因子,f 能量因子
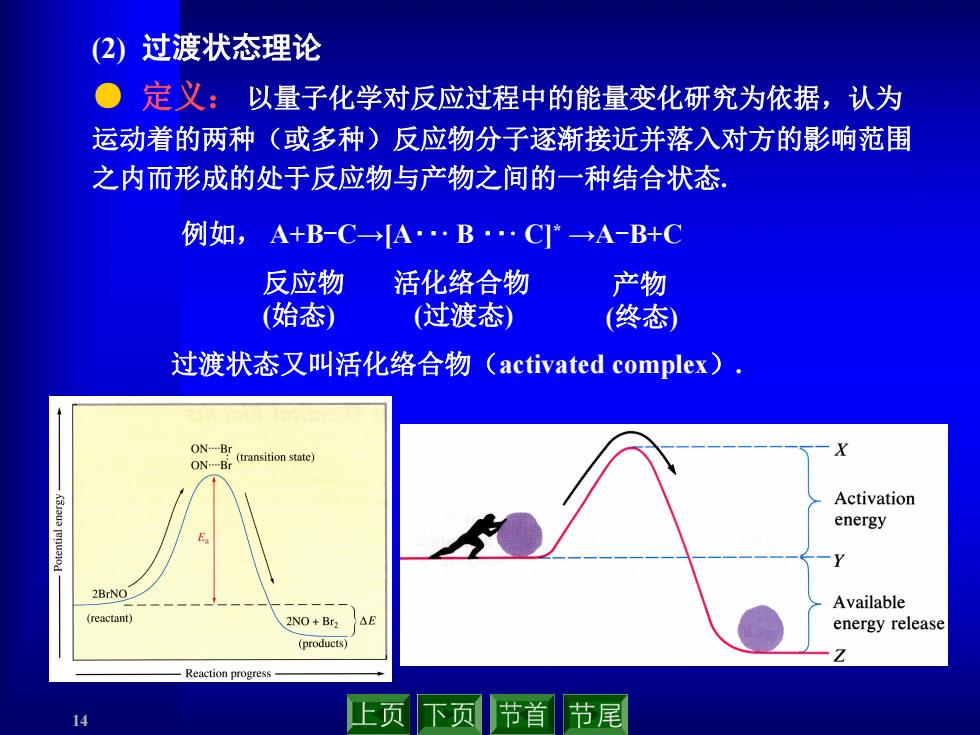
(2)过渡状态理论 ●定义:以量子化学对反应过程中的能量变化研究为依据,认为 运动着的两种(或多种)反应物分子逐渐接近并落入对方的影响范围 之内而形成的处于反应物与产物之间的一种结合状态 例如,A+B-C→A.B.C→A-B+C 反应物 活化络合物 产物 (始态) (过渡态) (终态)》 过渡状态又叫活化络合物(activated complex), ON-Br ON-Br (transition state) Activation energy 2BrNO Available (reactant) 2NO+Br2 AE energy release (products) Reaction progre 14 上页下页 节首节尾
14 (2) 过渡状态理论 ● 定义: 以量子化学对反应过程中的能量变化研究为依据,认为 运动着的两种(或多种)反应物分子逐渐接近并落入对方的影响范围 之内而形成的处于反应物与产物之间的一种结合状态. 例如, A+B-C→[A‥· B ‥· C] * →A-B+C 反应物 (始态) 过渡状态又叫活化络合物(activated complex). 活化络合物 (过渡态) 产物 (终态)
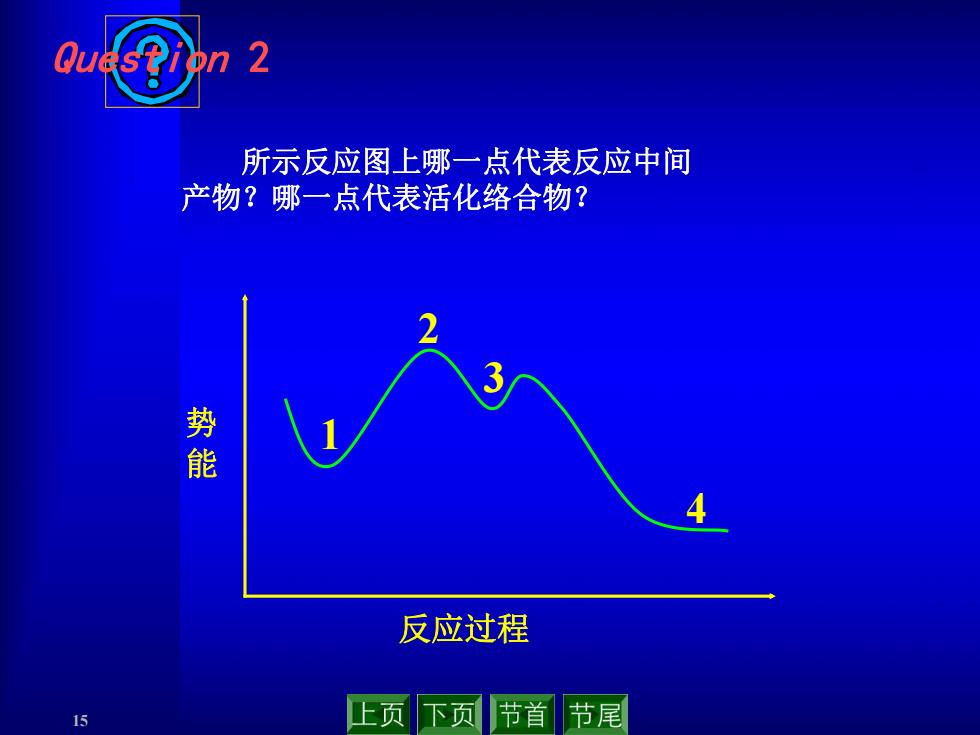
所示反应图上哪一点代表反应中间 产物?哪一点代表活化络合物? 能 反应过程 15 上页下页 节首节尾
15 Question 2 所示反应图上哪一点代表反应中间 产物?哪一点代表活化络合物? 1 2 3 4 势 能 反应过程