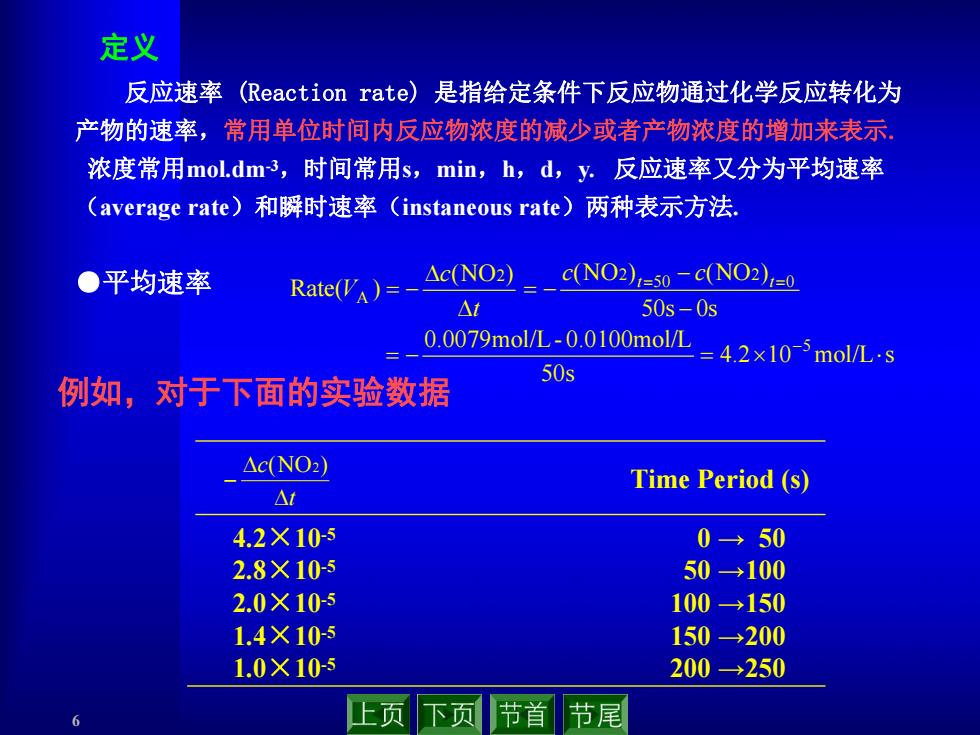
定义 反应速率 (Reaction rate))是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示, 浓度常用mol.dm3,时间常用s,min,h,d,y.反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法, ●平均速率 Rate(VA)=- △cNO2 c(NO2)=50-c(NO2)=0 △t 50s-0s 0.0079molL-0.0100molL=42×10-5molL-s 50s 例如,对于下面的实验数据 △c(NO) Time Period (s) △7 4.2×105 0→50 2.8×10-5 50→100 2.0×105 100→150 1.4×10-s 150→200 1.0×10-5 200→250 上页下页 节首 节尾
6 反应速率 (Reaction rate) 是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dm-3,时间常用s,min,h,d,y. 反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法. 定义 4.2 10 mol/L s 50s 0.0079mol/L- 0.0100mol/L 50s 0s (NO ) (NO ) (NO ) Rate( ) 5 0 2 50 2 2 A t t c c t c V t c (NO2) Time Period (s) 4.2×10-5 2.8×10-5 2.0×10-5 1.4×10-5 1.0×10-5 0 → 50 50 →100 100 →150 150 →200 200 →250 ●平均速率 例如,对于下面的实验数据

Example 2 用反应物和产物表示都可以 Rate of consumption Rate of production 2(Rate of production of NO2 ofNO of02) △c(NO2) △cNO) At △t △ 对于一般的化学反应: aA +bB +Y 3Z dCA dcB dcy dcz adt bdt ydt zdt ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化 ▲速率方程相同,但各自的不同. 止页下页 节首节尾
7 Rate of consumption of NO2 Rate of production of NO 2(Rate of production of O2 = = ) t c (NO2) t c (NO) t c(O ) 2 2 = = z t c y t c b t c a t c d d d d d d d d A B Y Z aA + bB yY + zZ ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化. ▲速率方程相同,但各自的k不同. 对于一般的化学反应: 用反应物和产物表示都可以 Example 2

u® 反应2W+X一Y+Z哪种速率表达式是正确的? dc() dc(Y) dt dt b de(X) dc(W) dt dt dc(Z) dc(Y) c dt dt dc(W) d. dc(Z) dt dt 上页下页节首 节尾
8 Question 1 反应 2W+X Y+Z 哪种速率表达式是正确的? t c W t c Z t c Y t c Z t c W t c X t c Y t c X d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d d ( ) d. c. b. a.

1.00 瞬时速率 Rate5.4×10-4mol/L·s .80 瞬时速率只能用作图 的方法得到,例如对于 11110 Rate¥2.7×10-4mol/L·s .60 反应(45℃): (SOZN) .40 2N205→4N02+02 .20 dc(N2O;) =- di 400 800 12001600 2000 lim v Time (s) △1-→0 C(N2Os)/mol-L-1 Rate/mol(Ls-1) 0.90 5.4X10- 0.45 2.7×104 9 上页 下页 节首节尾
9 v t 0 lim ● 瞬时速率 t c v d d (N2O5) C(N2O5)/mol·L-1 Rate/mol(L ·s -1) 0.90 5.4×10-4 0.45 2.7×10-4 瞬时速率只能用作图 的方法得到,例如对于 反应(45 ℃ ): 2N2O5 →4NO2+O2

3.2反应速率理论简介 (briefly introductory to reaction rate theory) 化学反应的发生总是伴随电子的转移或重新分配,这种转移 或重新分配似乎只有通过相关原子的接触才可能实现。 (1)碰撞理论 1918年lewis以气体分子运动论为基础提出. 对于反应 O3(g)+NO(g)→NO2(g)+O2(g〉 v=kc(NO)c(O3) 发生有效碰撞的两个基本前提: 。碰撞粒子的动能必须足够大 ●对有些物种而言,碰撞的几何方位要适当 10 止页下页节首节尾
10 3.2 反应速率理论简介 (briefly introductory to reaction rate theory) 1918年 lewis 以气体分子运动论为基础提出. 发生有效碰撞的两个基本前提: ● 碰撞粒子的动能必须足够大 ● 对有些物种而言,碰撞的几何方位要适当 O (g) NO(g) NO (g) O (g) 3 2 2 (NO) (O ) 3 kc c 对于反应 (1)碰撞理论 化学反应的发生总是伴随电子的转移或重新分配,这种转移 或重新分配似乎只有通过相关原子的接触才可能实现