
翻转课堂: 问题二: 强酸:H2S04、HCl 弱酸:HAc 强碱:NaOH 弱碱:Na2C03 请问:如何判断酸碱的强弱?
请问:如何判断酸碱的强弱? 问题二: 强酸:H2SO4 、HCl 弱酸:HAc 强碱:NaOH 弱碱:Na2CO3 翻转课堂:
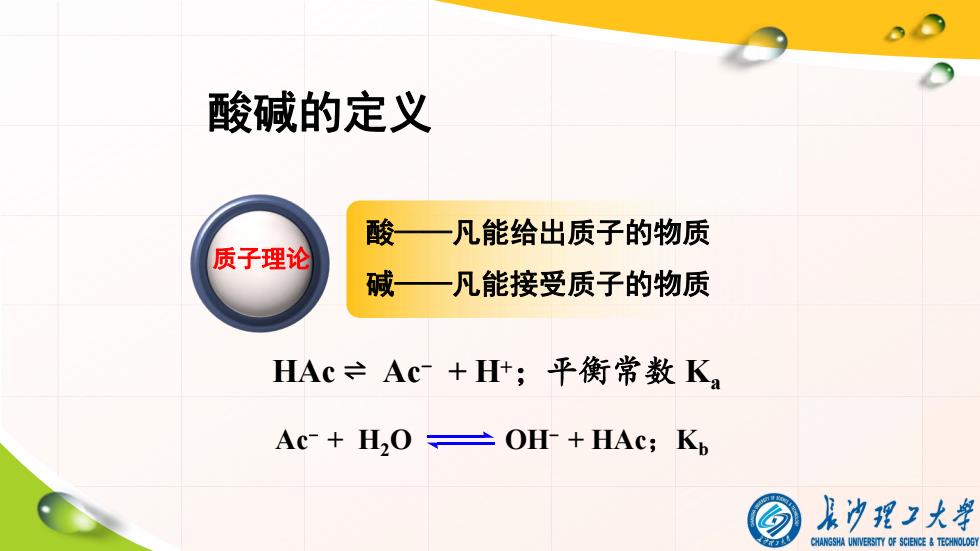
酸碱的定义 酸一凡能给出质子的物质 质子理论 碱—凡能接受质子的物质 HAc=Ac+Ht;平衡常数K? Ac-+H,OOH-+HAc;Kp 朵功理工大弹 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY
酸碱的定义 酸——凡能给出质子的物质 碱——凡能接受质子的物质 质子理论 HAc ⇌ Ac - + H+;平衡常数 Ka Ac - + H2O OH- + HAc;Kb
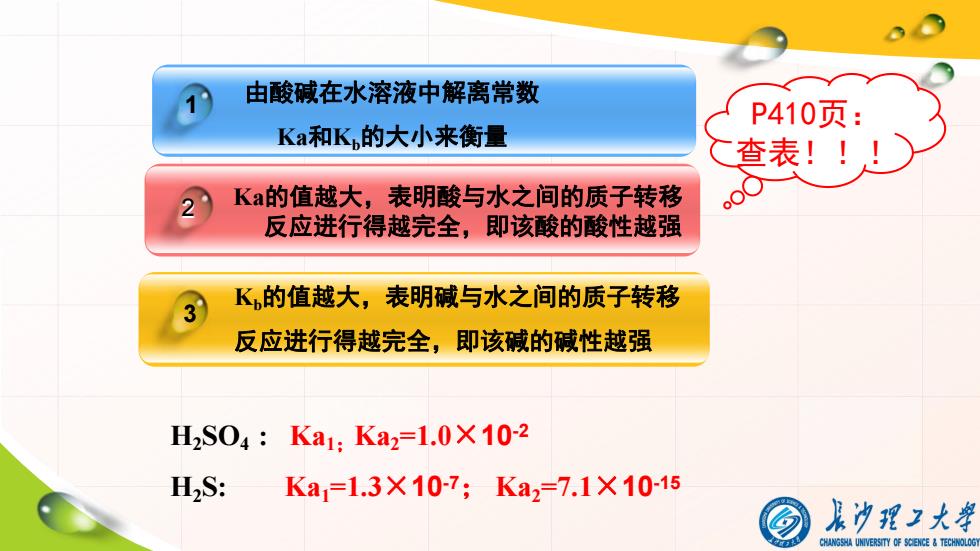
由酸碱在水溶液中解离常数 P410页: Ka和K的大小来衡量 查表!! 2 Ka的值越大,表明酸与水之间的质子转移 oo● 反应进行得越完全,即该酸的酸性越强 K的值越大,表明碱与水之间的质子转移 反应进行得越完全,即该碱的碱性越强 H2S04:Ka1:Ka2=1.0X102 H,S: Ka=1.3×10-7;Ka2=7.1×1015 最冲理2大举 CHANGSHA UNIVERSITY OF SCENCE TECHNOLOG
由酸碱在水溶液中解离常数 Ka和Kb的大小来衡量 Ka的值越大,表明酸与水之间的质子转移 反应进行得越完全,即该酸的酸性越强 Kb的值越大,表明碱与水之间的质子转移 反应进行得越完全,即该碱的碱性越强 1 2 3 P410页: 查表!!! H2SO4 : Ka1;Ka2=1.0×10-2 H2S: Ka1=1.3×10-7; Ka2=7.1×10-15

翻转课堂: 问题三: 弱酸: HAc: K=1.8×10-5 共轭碱:NaAc: Kp=? 弱碱: NH:H2O: Kb=1.8×10-5 共轭酸:NH4C: K2=? 为什么有些酸碱的离解常数 查不到?该如何得到? 充分利用:Kw、K、Kb
问题三: 弱碱: NH3 ∙H2O: Kb=1.8×10-5 共轭酸:NH4Cl: Ka =? 弱酸: HAc : Ka = 1.8×10-5 共轭碱:NaAc: Kb=? 为什么有些酸碱的离解常数 查不到?该如何得到? 充分利用:Kw、Ka 、Kb 翻转课堂:
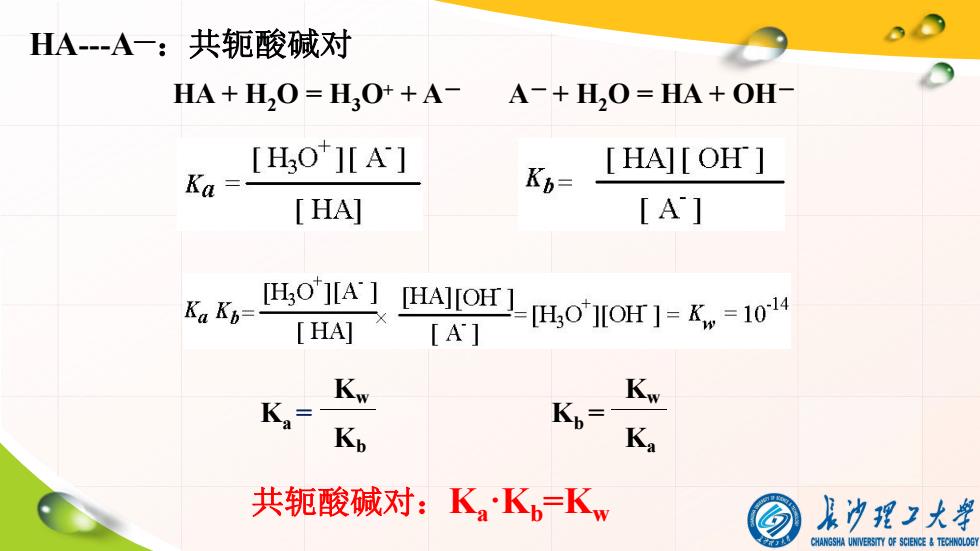
HA--A一:共轭酸碱对 HA+H20=L0++A- A-+H,O=HA+OH- [HOJ[A] [HAJ[OH] Ka= K6= HA] [A] Ka Kp= [HO'I[A THAJIOH ] [HA] [A] H,O][OH]=K。=1014 Kw Kw Ka- Kp Kp= Ka 共酸碱对:KaKb=K, 及为理2大舞 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY
HA + H2O = H3O+ + A- A- + H2O = HA + OH- Ka = Kw Kb Kb = Kw Ka HA---A—:共轭酸碱对 共轭酸碱对:Ka ·Kb=Kw