
③液氨自偶电离 NH3⑩+NH3⑩=NH4++NH2 240K,K=10-29,很小→液氨是电不良导体 类似H20+H20=H30*+OH295K,Kw=1.0X10-14 .NH3)<(H2O) ∴.极性弱的化合物在液氨中溶解度↑ 例:水中溶解度 AgF >AgCI >AgBr>AgI 液氨中溶解度AgF<AgCI<AgBr<AgI
NH3 (l) + NH3 (l) = NH4 + + NH2 - 240 K, K =10-29 , 很小 → 液氨是电不良导体 类似 H2O + H2O = H3O+ + OH- 295 K, Kw =1.0×10-14 ∵μ(NH3 ) < μ(H2O) ∴极性弱的化合物在液氨中溶解度↑ 例: 水中溶解度 AgF > AgCl > AgBr > AgI 液氨中溶解度 AgF < AgCl < AgBr < AgI ③液氨自偶电离

④取代反应 两种类型 (a)NHL3中H被取代: 例:2Na+2NH3→2Na+NH2+H2(g) 对比2Na+H,0→2Na0H+H2(g) 2Al 2NH32AIN 3H2(g) AN是原子晶体,熔点高,硬度大。 原子晶体:质点间作用力强,靠共价键结合; 键能大,熔沸点高,硬度大,延展性差,不导电
④取代反应 两种类型 (a) NH3中H被取代: 例: 2Na + 2NH3 → 2Na+NH2 - + H2 (g) 对比 2Na + H2O → 2NaOH + H2 (g) 2Al + 2NH3 → 2AlN + 3H2 (g) AlN是原子晶体,熔点高,硬度大。 原子晶体:质点间作用力强,靠共价键结合; 键能大,熔沸点高,硬度大,延展性差,不导电

(b) 氨解反应 NH以-NH2(氨基)或=NH(亚氨基)取代其它化 合物中的原子或原子团: 例1C-Hg-CI+2H-NH2=C-Hg-NH2↓+NHCI 氯化氨基汞 对比“水解反应”: CI-Hg-CI H-OH CI-Hg-OH HCI H 氯化羟基汞 例2 十一 光气(二氯碳酰) 尿素
例1 Cl-Hg-Cl + 2 H-NH2 = Cl-Hg-NH2↓+NH4Cl 氯化氨基汞 对比“水解反应”: Cl-Hg-Cl + H-OH = Cl-Hg-OH + HCl 氯化羟基汞 Cl C Cl O +4HNH2 C H2N H2N O+2NH4Cl 光气(二氯碳酰) 尿素 例2 (b) 氨解反应 NH3以-NH2(氨基)或=NH(亚氨基)取代其它化 合物中的原子或原子团:
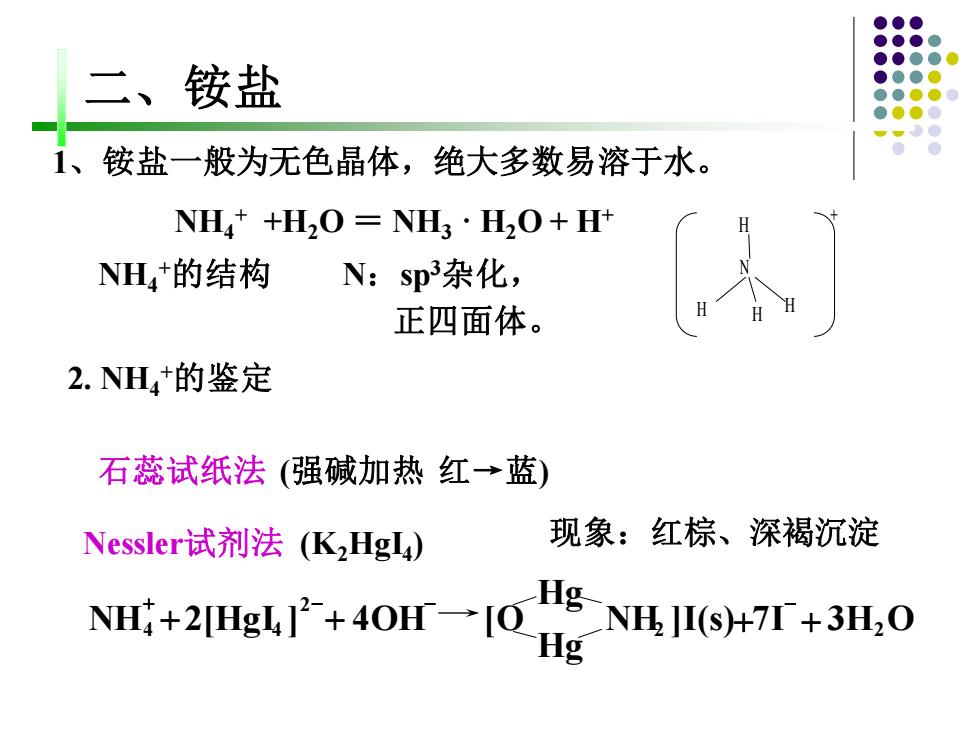
二、铵盐 1、铵盐一般为无色晶体,绝大多数易溶于水。 NH4+H2O=NH3·H2O+Ht NH4+的结构 N:sp杂化, 正四面体。 2.NH4+的鉴定 石蕊试纸法(强碱加热红→蓝) Nessleri试剂法(K2HgI4) 现象:红棕、深褐沉淀 NH4+2[HgL+4OH→IO Hg-NH.JI($)+7T+3H.O
1、铵盐一般为无色晶体,绝大多数易溶于水。 NH4 + +H2O = NH3 · H2O + H+ H N H H H + 二、铵盐 石蕊试纸法 (强碱加热 红→蓝) Nessler试剂法 (K 现象:红棕、深褐沉淀 2HgI4 ) NH4 +的结构 N:sp3杂化, 正四面体。 NH ]I(s) 7I 3H O Hg Hg NH 2[HgI ] 4OH [O 2 2 2 4 + 4 + + + + - - - 2. NH4 +的鉴定

3.热稳定性差 ()挥发性非氧化性酸铵盐 NIT1 NKEHCI(2) OICOA KECOO NHG今CQO( (2)非挥发性,非氧化性酸铵盐 (下P3>CPC (下>C⊕4IA
(1)挥发性非氧化性酸铵盐 NHHCO NH(g)CO(g)HO(g) (NH)CO 2NH(g)CO(g)HO(g) NHCl NH(g)HCl(g) 4 3 3 2 2 4 2 3 3 2 2 4 3 ⎯→ + + ⎯→ + + ⎯→ + (2)非挥发性,非氧化性酸铵盐 42 4 3 4 4 43 4 3 3 4 (NH)SO NH(g)NHSO (NH)PO 3NH(g)HPO ⎯→ + ⎯→ + 3. 热稳定性差