
④泰山医学院 省级精品课程申报 R 图Ⅲ-4-3沸点仪 图1I1-4-5回流 本实验是以恒沸点为界,把相图分成左右两半,分两次来绘制相图的。具体方法如下 ①右一半沸点一组成关系的测定 在三口瓶中加入20mL异丙醇和1mL环己烷,再加入儿小块沸石,按上述方法测定 n和n,并记下温度t和t,然后依次加入1.5mL、2.0mL、2.5mL、3.0ml、6.0ml、 250ml坏己棕.。每加 一次环己烷都要按上述方法分别测定其n,和m及温度t,和。 实验完毕后将溶液倒入回收瓶中 ②左一半沸点一组成关系的测定 在三口瓶中加入50ml环己烷,依次加入0.3mL、0.5mL、0.7ml、1.0ml、2.5ml、 5.0mL、12.0ml的异丙醇,分别按①进行测定。 方法二:间歇测定法 在测定沸点与组成的关系时,也可以用间歇方法测定。每种含不同质量百分数的 溶液由教师事先配好,同学按顺序号依次测定。 把事先配好的第一份溶液25L加入沸点仪中,加入沸石,待沸腾稳定后,读取沸 点温度,立即停止加热。取气相冷凝液测其折射率,而后再取液相液体测其折射率, 然后用滴管取尽沸点仪中的测定液,放回原试剂瓶中。在沸点仪中再加入5L新的待 测液,用上述方法同样依次测定 注意: 在更换溶液时,务必用滴管取尽沸点仪中的测定液,以免带米误差 六、注意事项 1.由于整个体系并非绝对恒温,气、液两相的温度会有少许差别,因此沸点仪中, 温度计水银球的位置应一半浸在溶液中,一半露在蒸气中。并随着溶液量的增加要不 断调特水银求的位置 2.实验中尽可能避免过热现象 为此每加两次样品后,可加) 一小块沸石,同时 要控制好液体的回流速度,不宜过快或过慢(回流速度的快慢可调节加热温度来控制)。 3.在每一份样品的蒸馏过程中,由于整个体系的成分不可能保持恒定,因此平衡 温度会路有变化,特别是当溶液中两种组成的量相差较大时,变化更为明显。为此每 加入一次样品后,只要待溶液沸腾,正常回流1min一2min后,即可取样测定,不宜 连待时间计长 4.每次取样量不宜过多,取样时毛细滴管一定要干燥,不能留有上次的残液,气 相取样口的残液亦要擦干净。 5.整个实验过程中,通过折射仪的水温要恒定,使用折射仪时,棱镜不能触及硬 物(如滴管),擦拭棱镜用擦镜纸。 七、数据处理 1.将实验中测得的折射率一组成数据列表 并绘制成工作曲线 2将实验中测得的沸点一折射率数据列表,并从工作曲线上查得相应的组成,从 而获得沸点与组成的关系。 3.绘制沸点一组成图,并标明最低恒沸点和组成。 16

@泰山医学院 省级精品课程申报 4.在精确的测定中,还要对温度计的外露水银柱进行露茎校正。 【思考问题】 L.在该实验中,测定工作曲线时折射仪的恒温温度与测定样品时折射仪的恒温温 度是否需要保持 致?为什么 2过热现象对实验产生什么影响?如何在实验中尽可能避免 3.在连续测定法实验中,样品的加入量应十分精确吗?为什么? 4.试估计哪些因素是本实验的误差主要来源? 附录: 具有最低恒沸点的双液体系是很多的,除了本实验中介绍的环己烷异丙醇体系 外,下面再介绍其它二种体系,以便在实验中需要改变体系时作参考。 1.苯-乙醇体系 右半分支:先加入30mL乙醇,然后依次加入苯1.0mL、2.0ml、3.0mL、5.0mL、10.0mL、 15.0mL、17.5ml 左半分支:先加入50ml苯,然后依次加入乙醇0.5mL、1.0mL、1.5mL、2.0mL、3.0ml 5.0mL、13.5ml。 2.床己院-乙醇体系 右半分支:先加入20mL乙醇,然后依次加入环己烷0.5mL、1.0mL、1.5mL、2.0mL、 4.0mL、14.0ml、20.0mL. 左半分支:先加入50ml环己烷,然后依次加入乙醇0.2ml、0.4ml、0.6ml、0.8ml 1.0mL、2.0mL 14.0ml 实验三组分体系等温相图的绘制 一、实验目的 1.熟悉相律,掌握用三角形坐标表示三组分体系相图。 2.用溶解度法作出具有一对共轭溶液的苯一醋酸一水体系的相图(溶解度曲线及连 结线) 二、预习要求 1.掌握用溶解度法绘制相图的基本原理。 2.了解三角形坐标表示法。 三、实验原理 三组分体系K=3,当体系处于恒温恒压条件,根据相律,体系的条件自由度为 3-Φ式中 ①为体系 相 系最大 条件自由度 f*=3-1=2 因此,浓度变 量最多只有两个可用平面图表示体系状态和组成间的关系,称为三元相图。通常用等 边三角形坐标表示,见图Ⅲ-7-1所示。等边三角形顶点分别表示纯物A、B、C,AB、 BC、CA三条边分别表示A和B、B和C、C和A所组成的二组分体系的组成,三角形内 任何一点都表示三组分体系的组成。图-7-1中的P点,其组成表示如下:经P点作 于三角形三边的直线,并交三边于a、b、三点。若将三边均分成100等分 则E 点的A、B.C组成分别为:A%=Pa=Cb,B%=Pb=AC,C%=Pc=Ba:苯一醋酸一水是属 具有一对共轭溶液的三液体体系相图,即三组分中二对液体A和B,A和C完全互溶, 而另一对B和C只能有限度的混溶,见图Ⅲ-7-2所示。 17

④泰山医学院 省级精品课程申报 图-7-1等边三角形法表示三元相图 1工工-7-2共氟溶液的三元相图 图-7-2中,E、K、K、P、L、L、F点构成溶解度曲线,KL、KL等是连结线。溶 解度曲线内是两相区,即一层是苯在水中的饱和溶液,另一层是水在苯中的饱和溶液】 曲线外是单相 因此,利用体系在相变化时清浊现象的出现, 可以判断体系中各乡 分间互溶度的大小 一般由清变浑,肉眼较易分辨。所以本实验是向均相的苯一醋酸 体系滴加水使之变成二相混合物的方法,确定二相间的相互溶解度。 四、仪器药品 1.仪器 具塞锥形瓶(100ml,)2只:(25l)4只;酸式滴定管(20ml)1只:碱式滴定管(50ml)1 只:移液管(1mL、2mL)各1只:刻度移液管(10mL、20mlL)各1只:雏形瓶(150ml)2只。 2.药品 冰醋酸(分析纯):苯(分析纯):标准NaOH溶液(0.2mol·dm):酚酞指示剂。 五、实验步骤 1.测定互溶度曲线 在洁净的酸式滴定管内装水,用移液管取10.00ml苯及4.00ml,醋酸于干燥的 100L具塞锥形瓶中,然后慢慢滴加水,同时不停摇动,至溶液由清变浑,即为终点, 记下水的体积,再向此瓶中加入5.00L醋酸,体系又成均相,再用水滴定至终点,然 后依次用同样方法加入8.00l、8.00ml醋酸,分别用水滴至终点,记录每次各组分的 用量.最后再加入10.00ml苯和20.00mL水,加塞摇动,并每间隔5min摇动一次,30min 后用此溶液测连结线 另取一只干燥的100mL具塞锥形瓶,用移液管加入 1.00mL苯及 2.00ml醋酸,用水滴至终点,以后依次加入1.00ml、1.00mL、1.00m、1.00ml、2.00ml 10.00ml醋酸,分别用水滴定至终点,并记录每次各组分的用量。最后再加入15.00ml 苯和20.00ml水,每隔5min摇一次,30min后用于测定另一条连结线。 2.连结线的测定 上面所得的两份溶液,经半小时后,待二层液分清,用干燥的移液管(或滴管)分 别吸取上层液约5ml,下层液约1mL于已称重的4个25mL具塞锥形瓶中,再称其重量 然后用水洗入150L锥形瓶中,以酚酞为指示剂,用0.2o1·d血标准氢氧化钠溶液 滴定各层溶液中醋酸的含量。 六、注意事项 1因所训休系含右水的成分,故波璃器m收需干品 2.在滴加水的过程中须 且需不停地摇动锥形瓶,由于分散的“油珠” 颗粒能散射光线,所以体系出现浑浊,如在2min~3min内仍不消失,即到终点。当体 系醋酸含量少时要特别注意慢滴,含量多时开始可快些,接近终点时仍然要逐滴加入。 3.在实验过程中注意防止或尽可能减少苯和醋酸的挥发,测定连结线时取样要迅速
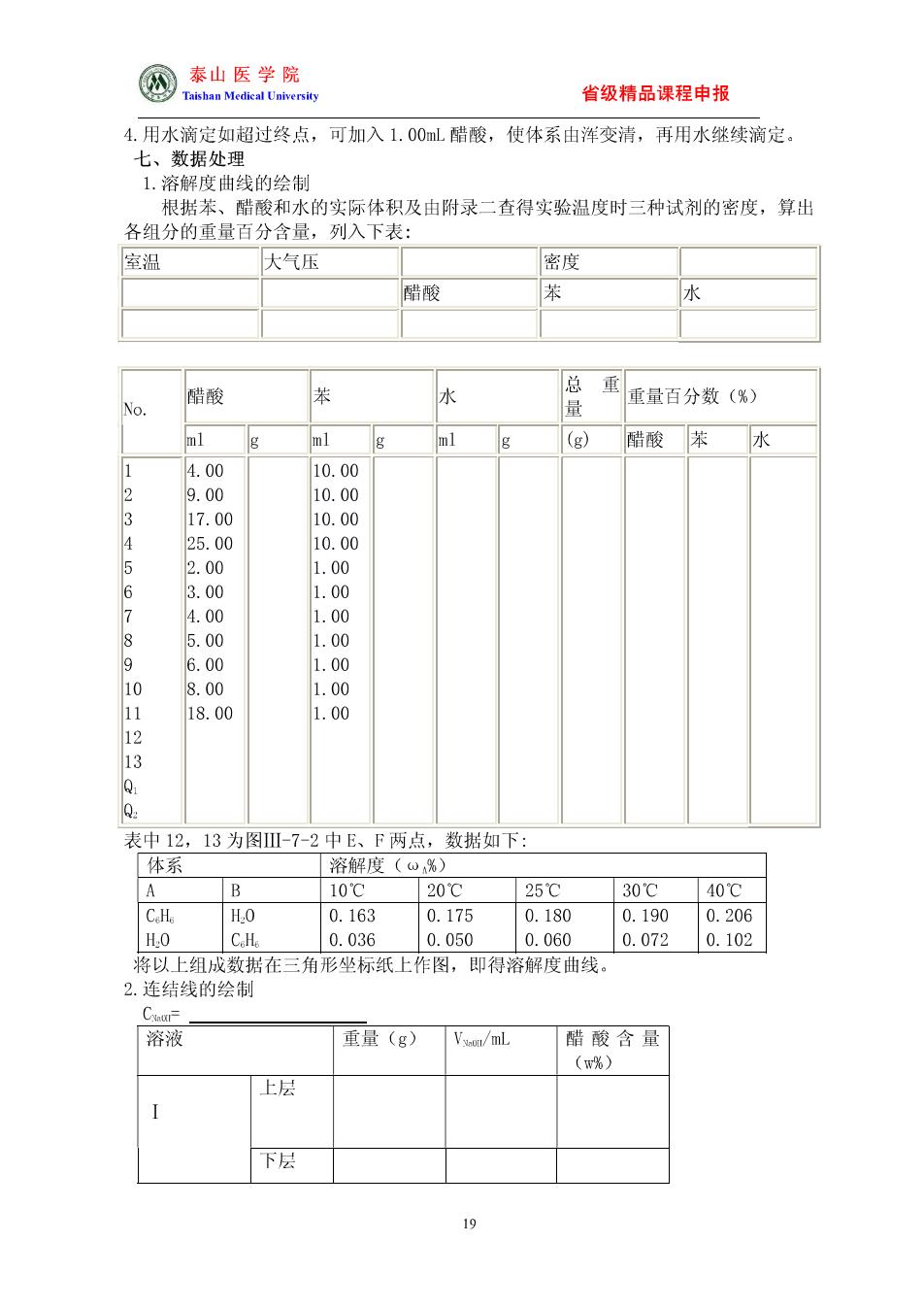
@泰山医学院 省级精品课程申报 4.用水滴定如超过终点,可加入1.00ml醋酸,使体系由浑变清,再用水继续滴定。 七、数据处理 1.溶解度曲线的绘制 根据苯、 醋酸和水的实际体积及由附录二查得实验温度时三种试剂的密度,算出 各组分的重量百分含量,列入下表: 室温 大气压 密度 蜡酸 醋酸 苯 水 总 重重量百分数(%) ml ml g (g) 醋酸苯 水 4.00 10.00 9. 00 4 25 10.00 2 00 1. 00 6 3 89 456 1 000 10 1.00 18.00 1.00 1 13 表中12,13为图-7-2中E、F两点,数据如下: 体系 溶解度(%) 10℃ 20 25 200400 H.O 0175 0180 0190 0.206 H.O 8配 0.050 0.060 0.072 0.102 将以上组成数据在三角形坐标纸上作图,即得溶解度曲线。 2.连结线的绘制 溶液 重量(g) V./mL 醋酸含量 上层 下层 10

网泰山医学院 省级精品课程申报 上层 下层 ()计算二瓶中最后醋酸、苯、水的重量百分数,标在三角形坐标纸上,即得相应的 物系点A和Q。 (②)将标出的各相醋酸含量点画在溶解度曲线上,上层醋酸含量画在含苯较多的一边, 下层画在含水较多的 一边,即可作出K和K两条连结线,它们应分别通过物系点 Q和。 【思考问题】 1.为什么根据体系由清变浑的现象即可测定相界? 2.如连结线不通过物系点,其原因可能是什么? 3.本实验中根据什么原理求出苯一醋酸一水体系的连结线? 实验 二组分金属相图的绘制 实验目的 1.学会用热分析法测绘Sn—Bi二组分金属相图。 2.了解热电偶测量温度和进行热电偶校正的方法 二、预习要求 1.了解纯物质的步冷曲线和混合物的步冷曲线的形状有何不同,其相变点的温度 应如何确定 2掌握热电偶测量温度的原理及校正方法。 三、实验原理 测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使 之的人今知.每 定间品一次识府 表示温度与时间关系的曲线叫步冷曲线 当熔体系在均匀冷却过程 无相变化时, 其温度将连 匀下降得到 光滑 的冷起 曲线:当体系内发生相变时,则因体系产生之相变热与自然冷却时体系放出的热量相抵 偿,冷却曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成合金的相 变温度。利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混 合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。 二元简单低共熔体系的冷却曲线具有图-5-1所示的形状。 : 图Ⅲ-5-1根据步冷曲线绘制相图 图Ⅲ-5-2有过冷现象时的步冷曲线 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保 证冷却速度足够慢才能得到较好的效果。此外,在冷却过程中,一个新的固相出现以 前,常常发生过冷现象,轻微过冷则有利于测量相变温度:但严重过冷现象,却会使折 点发生起伏, 使相变温度的确定产生困难。见图-5-2。遇此情况,可延长c线与 ab线相交,交点e即为转折点。 四、仪器药品 20