
对于气相反应,由于压力容易测定,所以速率也 可以表示为: N20,(g)=N204(g)+502(g) d[N,O;]_d[N,0.]d[:] dt dt dt r= dp,05_ dpN20s=2 poz dt dt dt r的单位是[压力][时间]1 对于理想气体PB=CBRT r =r(RT) 16
16 对于气相反应,由于压力容易测定,所以速率也 可以表示为: 2 5 2 4 2 1 N O (g) N O (g) O (g) 2 = + d N O d N O d O 2 5 2 4 2 2 d d d r t t t = − = = ' N O N O O 2 2 4 2 5 d d d 2 d d d p p p r t t t = − = = ' r r RT = ( ) B B p c RT = r ' 的单位是 [ -1 [压力] 时间] 对于理想气体

热力学回头看3 已知乙醇(1)在25摄氏度时的标准摩尔燃烧焓是-1367kmo1,C02(g)和 H20)在25摄氏度时的标准摩尔生成焓为-393.514Jmo1和-285.84 kJ mol-1。 计算乙醇(1)在25摄氏度时的标准摩尔生成焓。 解: C2H,OH(1)+302(g)=2CO2(g)+3HO(I) AHa(C2HOH,l)=2△H品(CO2,g)+3△H(H20,l) △Ha(C2HOH,I) △Ha(CHOH,1)=2△HR(CO2)+3△:HR(H2O,1)- △.H(C2HOH,I) =-275.4 kJ.mol1 17
热力学回头看3 17 已知乙醇(l)在25摄氏度时的标准摩尔燃烧焓是-1367 kJ mol-1 ,CO2 (g)和 H2O(l)在25摄氏度时的标准摩尔生成焓为-393.514 kJ mol-1和-285.84 kJ mol-1。 计算乙醇(l)在25摄氏度时的标准摩尔生成焓。 解:

热力学回头看4 在25摄氏度时,液态水的生成焓为-285.8kJmo1,又知在 25摄氏度至100摄氏度的温度区间内,氢气、氧气和液态水的 平均摩尔定压热容分别为28.83、29.16和75.31JK1mo1。 计算100摄氏度时液态水的生成焓。 解:反应方程式为 H2(g)+0.5O2(g)=H20(I) △Cp=75.31-28.83-0.5*29.16=31.90JK1mol1 △H2=△H1+△C。(T2-T1)=-283 kJ mol-1 18
18 在25摄氏度时,液态水的生成焓为-285.8 kJ mol-1 ,又知在 25摄氏度至100摄氏度的温度区间内,氢气、氧气和液态水的 平均摩尔定压热容分别为28.83、29.16和75.31 J K-1 mol-1 。 计算100摄氏度时液态水的生成焓。 解: 反应方程式为 H2 (g)+0.5 O2 (g) = H2O(l) △Cp = 75.31-28.83-0.5*29.16 = 31.90 J K-1 mol-1 △H2 = △H1+ △Cp (T2 -T1)=-283 kJ mol-1 热力学回头看4
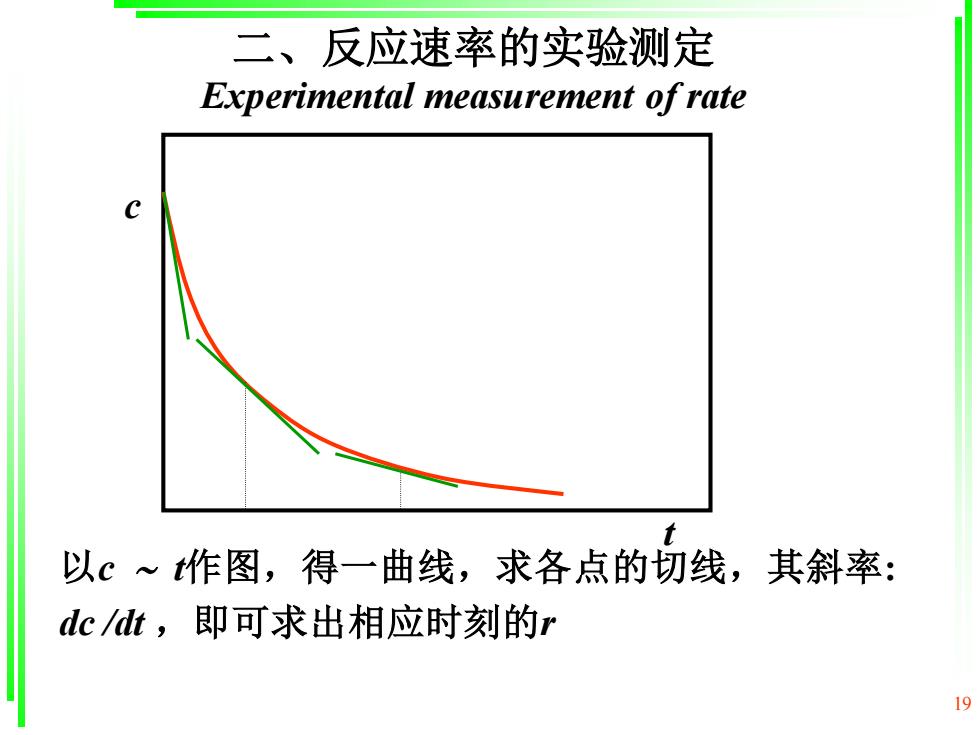
二、反应速率的实验测定 Experimental measurement of rate 以c~作图,得一曲线,求各点的切线,其斜率: dcdt,即可求出相应时刻的r 19
19 以c t作图,得一曲线,求各点的切线,其斜率: dc /dt ,即可求出相应时刻的r c t 二、反应速率的实验测定 Experimental measurement of rate

浓度测定方法分为1.化学法,2.物理法 1、化学法: 化学分析法测浓度关键是“冻结反应”,方法 有:骤冷、冲稀、加阻化剂或脱离催化剂等。 其优点是设备简单,测量直接; 缺点是很难找到合适的“冻结方法”。 2、物理法: 测量某种物理性质,条件是该性质与浓度有 单值函数关系。 压力,旋光度、折光率、电导、比色、光谱等 物理性质均可应用,其优点是间接测量,不干扰反 应,方便,迅速,可连续测定。 20
20 浓度测定方法分为1.化学法,2.物理法 1、化学法: 化学分析法测浓度关键是“冻结反应” ,方法 有:骤冷、冲稀、加阻化剂或脱离催化剂等。 其优点是设备简单,测量直接; 缺点是很难找到合适的“冻结方法” 。 2、物理法: 测量某种物理性质,条件是该性质与浓度有 单值函数关系。 压力,旋光度、折光率、电导、比色、光谱等 物理性质均可应用,其优点是间接测量,不干扰反 应,方便,迅速,可连续测定