
(③)硼的氧化物:通过B与O2反应或HBO3加热脱水得到.加热脱 水红热时得玻璃态B,O3,减压历时二周加热到670K得晶体状 B203.1273K以上得蒸气. 136pm 90-125° B120 pm 无定形B2O3 蒸气分子 B2O3主要显酸性,有时又像碱性氧化物: B,03+Co0=Co(B02)2 B203+P205=2BPO2 B03溶于水生成硼酸,但在热的水蒸气中生成可挥发的偏硼酸: B203+3H20H3B03 B203+3H20(水蒸气)一2HB02
硼的氧化物 通过 B 与 O2反应或 H3BO3 加热脱水得到. 加热脱 水红热时得玻璃态 B2O3,减压历时二周加热到 670 K 得晶体状 B2O3 . 1273 K 以上得蒸气. B2O3 主要显酸性,有时又像碱性氧化物: B2O3 + CoO Co(BO2)2 B2O3 + P2O5 2BPO2 B2O3溶于水生成硼酸,但在热的水蒸气中生成可挥发的偏硼酸: B2O3 + 3H2O H3BO3 B2O3 + 3H2O(水蒸气) 2HBO2 无定形B2O3 蒸气分子 O B O B O 136 pm 120 pm 90-125°

10.3.3硼的三卤化物 BF; BCI BBr3 B为sp杂化态 (1)性质 卤化物 熔点/℃ 沸点/℃ 4,G日Nmol-1 BF3 -127 -100 -1112 BCI3 -107 12 -339 BBr3 -46 91 -232 BI3 49 210 21 ●最后一栏指25℃时BX3气态的生成自由能 ; ●表中性质的这种变化趋势与分子间色散力的变化趋势相一致; ●BX3气、固、液态都不形成二聚体;
10.3.3 硼的三卤化物 BBr3 BCl3 BF3 B 为 sp2杂化态 (1) 性质 卤化物 BF3 BCl3 BBr3 BI3 熔点/℃ – 127 – 107 – 46 49 沸点/℃ – 100 12 91 210 – 1112 – 339 – 232 21 1 /kJ mol θm Δf G ● 最后一栏指 25 ℃ 时 BX3 气态的生成自由能 ; ● 表中性质的这种变化趋势与分子间色散力的变化趋势相一致 ; ● BX3 气、固、液态都不形成二聚体;
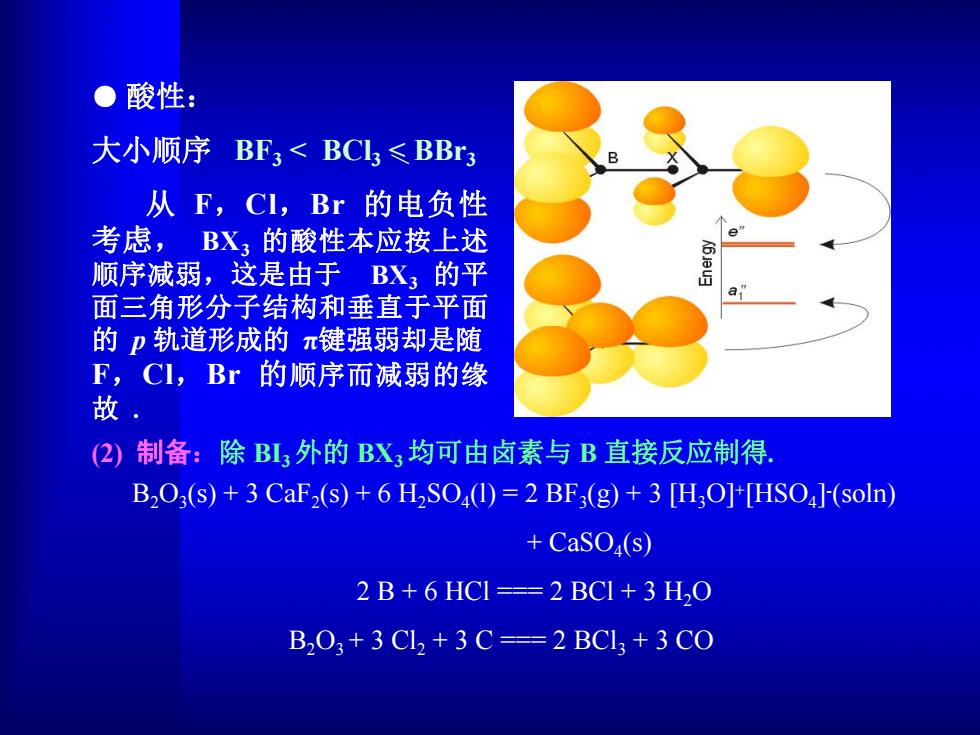
●酸性: 大小顺序BF3<BCI≤BBr3 从F,CI,Br的电负性 考虑,BX,的酸性本应按上述 顺序减弱,这是由于BX3的平 面三角形分子结构和垂直于平面 的p轨道形成的π键强弱却是随 F,CI,Br的顺序而减弱的缘 故, (2)制备:除BL3外的BX,均可由卤素与B直接反应制得. B2O3(s)+3 CaF2(s)+6 H2SO(1)=2 BF3(g)+3 [H3O]+[HSO4]-(soln) +CaSO4(s) 2B+6 HCI===2BCI+3 H2O B203+3Cl2+3C==2BCl3+3CO
● 酸性: 大小顺序 BF3 < BCl3 < BBr3 从 F,Cl,Br 的电负性 考虑, BX3 的酸性本应按上述 顺序减弱,这是由于 BX3 的平 面三角形分子结构和垂直于平面 的 p 轨道形成的 π键强弱却是随 F,Cl,Br 的顺序而减弱的缘 故 . (2) 制备:除 BI3外的 BX3均可由卤素与 B 直接反应制得. B2O3(s) + 3 CaF2(s) + 6 H2SO4(l) = 2 BF3(g) + 3 [H3O]+[HSO4] -(soln) + CaSO4(s) 2 B + 6 HCl === 2 BCl + 3 H2O B2O3 + 3 Cl2 + 3 C === 2 BCl3 + 3 CO
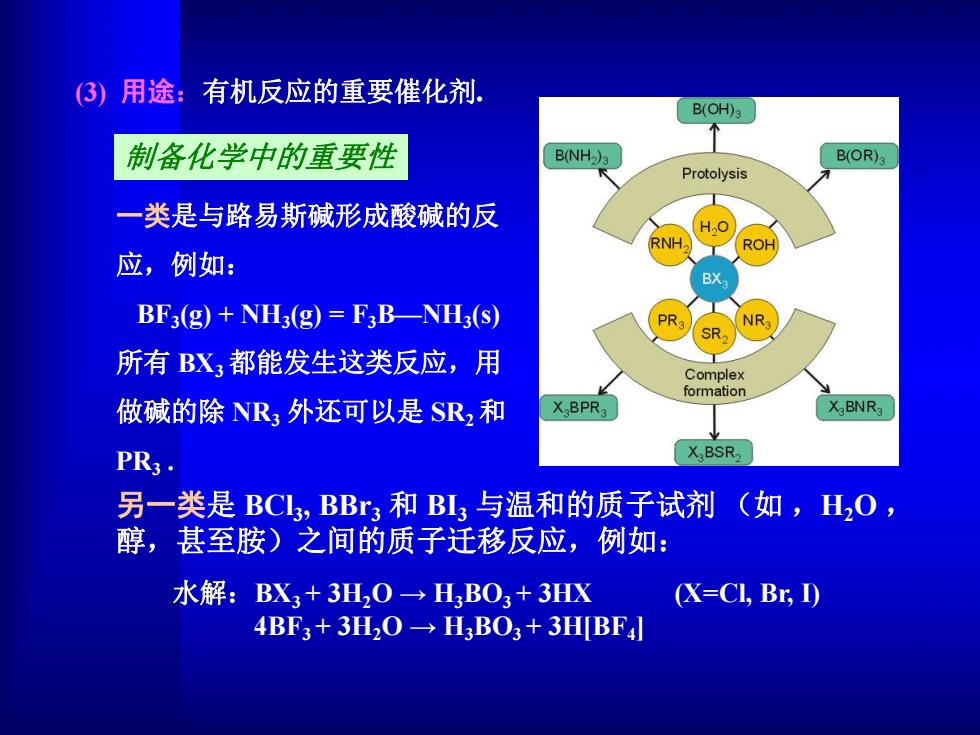
(③)用途:有机反应的重要催化剂。 B(OH)3 制备化学中的重要性 B(NH2)a B(OR) Protolysis 一类是与路易斯碱形成酸碱的反 H.O RNH ROH 应,例如: BX BF3(g)+NH3(g)=F3B-NH3(s) PR NR SR 所有BX3都能发生这类反应,用 Complex formation 做碱的除NR3外还可以是SRz和 X BPR XaBNRa PR3. X.BSR. 另一类是BCL3,BB3和BL3与温和的质子试剂(如,H2O, 醇,甚至胺)之间的质子迁移反应,例如: 水解:BX3+3H2O→HBO3+3HX (X=CI,Br,I) 4BF3+3H20→HBO3+3HBF
(3) 用途:有机反应的重要催化剂. 制备化学中的重要性 一类是与路易斯碱形成酸碱的反 应,例如: BF3(g) + NH3(g) = F3B—NH3(s) 所有 BX3都能发生这类反应,用 做碱的除 NR3 外还可以是 SR2和 PR3 .水解:BX3 + 3H2O → H3BO3 + 3HX (X=Cl, Br, I) 4BF3 + 3H2O → H3BO3 + 3H[BF4] 另一类是 BCl3 , BBr3 和 BI3 与温和的质子试剂 (如 ,H2O , 醇,甚至胺)之间的质子迁移反应,例如:

判断下列反应的产物并写出化学方程式: 1. BF3与过量NaF在酸性水溶液中的反应; 2.BCL3与过量NaC在酸性水溶液中的反应; 3.BBr3与过量NH(CH)2在烃类溶剂中的反应, 1.BF3是硬Lews酸,对F.(硬的中强碱)具有较高的亲和力, 反应形成配合物:BF3(g)+F(aq)BFr(aq),过量的F 和酸是为了防止pH过高而水解,例如形成BF3OH 2.发生水解,而不是与C配位: BCl3(g)+3 H2O(1)-H3BO3 (aq)+3 HCI(ag) 3.BBr3发生质子转移形成B一N键: BBr3(g)+3 NH(CH3)2B(N(CH3)2)3+3 HBr(g)
Question 4 判断下列反应的产物并写出化学方程式: 1. BF3 与过量 NaF 在酸性水溶液中的反应; 2. BCl3与过量 NaCl在酸性水溶液中的反应; 3. BBr3与过量 NH(CH3)2在烃类溶剂中的反应. 1. BF3 是硬 Lewis 酸,对 F-(硬的中强碱)具有较高的亲和力, 反应形成配合物:BF3(g) + F-(aq) [BF4] -(aq) ,过量的F- 和酸是为了防止 pH 过高而水解,例如形成 [BF3OH] -. 2. 发生水解,而不是与 Cl -配位: BCl3(g) + 3 H2O(l) → H3BO3 (aq) + 3 HCl(aq) 3. BBr3发生质子转移形成 B—N 键: BBr3(g) + 3 NH(CH3)2 B(N(CH3)2)3 + 3 HBr(g)