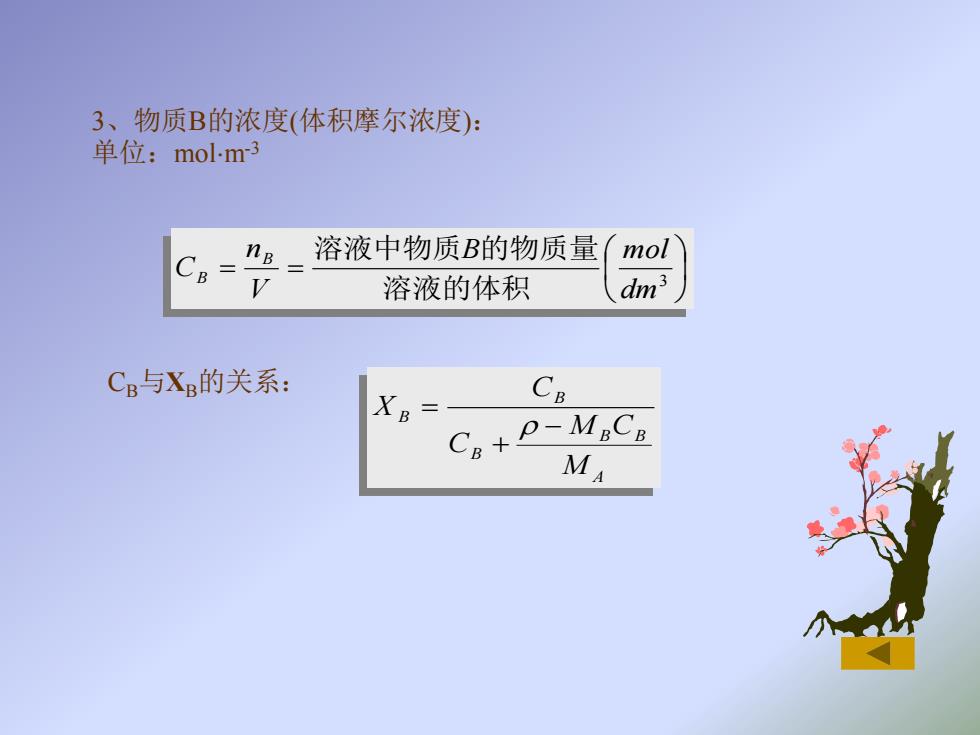
3、物质B的浓度(体积摩尔浓度): 单位:molm3 CB- ng_溶液中物质B的物质量 mol V 溶液的体积 dm3 CB与XB的关系: XB CR Cn+P-MaCa MA
3、物质B的浓度(体积摩尔浓度): 单位:molm-3 CB与XB的关系: A B B B B B M M C C C X − + = = = 3 dm B mol V n C B B 溶液的体积 溶液中物质 的物质量

4、物质B的质量摩尔浓度:b单位:mol.kg1 溶液中物质B的物质量 mol 溶剂的质量 kg bB与XB的关系: bB XB-1+bB MA
4、物质B的质量摩尔浓度:bB 单位:molkg-1 bB与ΧB的关系: B A B B b M b X + = 1 = k g B mol bB 溶剂的质量 溶液中物质 的物质量

§4-2稀溶液的两个经验定律 Expression law of dilute solution 实验证明:非电解质的稀溶液某温度下处于液一气平衡时,液相组 成与气相分压存在着一定的规律,这就是:溶剂服从Raoult?定律,溶质 服从Henry定律。 1886年拉乌尔(Raoult)根据实验得出蒸汽压与组成的关系 拉乌尔定律 Raoult's law 某温度下,溶剂的蒸气分压即⅓等于同温度下纯溶剂的饱 和蒸气压pA与溶液中溶剂的摩尔分数xA之乘积。 PA=PAXA (xA→1)》
§4-2 稀溶液的两个经验定律 Expression law of dilute solution 某温度下,溶剂的蒸气分压pA等于同温度下纯溶剂的饱 和蒸气压pA与溶液中溶剂的摩尔分数xA之乘积。 一、拉乌尔定律 Raoult’s law A A A p p x * = 1886年拉乌尔(Raoult)根据实验得出蒸汽压与组成的关系 实验证明:非电解质的稀溶液某温度下处于液—气平衡时,液相组 成与气相分压存在着一定的规律,这就是:溶剂服从Raoult定律,溶质 服从Henry 定律。 ( xA→1)

1、Raoult定律还可表示为:某温度下溶剂的蒸气压下降△pA (△PA=PA*一PA) 等于同温度下纯溶剂的饱和蒸气压*与溶液中的溶质的 摩尔分数x之乘积。 即:△pA=(PA*一PA)=pA*xB (xB→0) 2、Raoult定律适用于稀溶液,与溶质是否挥发无关
1、Raoult定律还可表示为:某温度下溶剂的蒸气压下降Δ pA (Δ pA= pA* - pA) 等于同温度下纯溶剂的饱和蒸气压pA* 与溶液中的溶质的 摩尔分数xB之乘积。 即:Δ pA = (pA* - pA)= pA* xB ( xB→0) 2、Raoult 定律适用于稀溶液,与溶质是否挥发无关

亨利定律 Henry's law 1803年亨利根据实验得出溶质的蒸汽压与组成的关系: 在一定温度和平衡态下稀溶液中挥发性溶质(B)在气 相中的分压(P)与其在溶液中摩尔分数(X)成正比,称为 亨利定律。 PB-kx.BXB (xB→0) kB单位:Pa 式中k,B一亨利常数,其值与温度、溶剂、溶质有关
在一定温度和平衡态下稀溶液中挥发性溶质(B)在气 相中的分压(PB)与其在溶液中摩尔分数(ΧB)成正比,称为 亨利定律。 二、亨利定律 Henry’s law 1803年亨利根据实验得出溶质的蒸汽压与组成的关系: pB=kx,BΧB kx,B单位:Pa ( →0) B x 式中kx,B—亨利常数,其值与温度、溶剂、溶质有关