
上页 下页 目录 返回 ◆离子极化对化合物性质的影响 ● 熔点和沸点降低 如,在BeCl2等化合物中,Be2+ 半径最小,又是2电子构型,因此Be2+有很大的极化能 力,使Cl-发生比较显著的变形,Be2+和Cl-之间的键 有较显著的共价性。因此BeCl2具有较低的熔、沸点 (410℃) 。 ● 溶解度降低 离子极化使离子键逐步向共价键过渡 ,根据相似相溶的原理,离子极化的结果必然导致化 合物在水中溶解度的降低。 ● 化合物的颜色 在一般情况下,如果组成化合物的两 种离子都是无色的,则化合物也无色,如NaCl、KNO3 ,如果其中一种离子无色,则另一种离子的颜色就是该 化合物的颜色,如 K2CrO4 呈黄色
上页 下页 目录 返回 ◆离子极化对化合物性质的影响 ● 熔点和沸点降低 如,在BeCl2等化合物中,Be2+ 半径最小,又是2电子构型,因此Be2+有很大的极化能 力,使Cl-发生比较显著的变形,Be2+和Cl-之间的键 有较显著的共价性。因此BeCl2具有较低的熔、沸点 (410℃) 。 ● 溶解度降低 离子极化使离子键逐步向共价键过渡 ,根据相似相溶的原理,离子极化的结果必然导致化 合物在水中溶解度的降低。 ● 化合物的颜色 在一般情况下,如果组成化合物的两 种离子都是无色的,则化合物也无色,如NaCl、KNO3 ,如果其中一种离子无色,则另一种离子的颜色就是该 化合物的颜色,如 K2CrO4 呈黄色
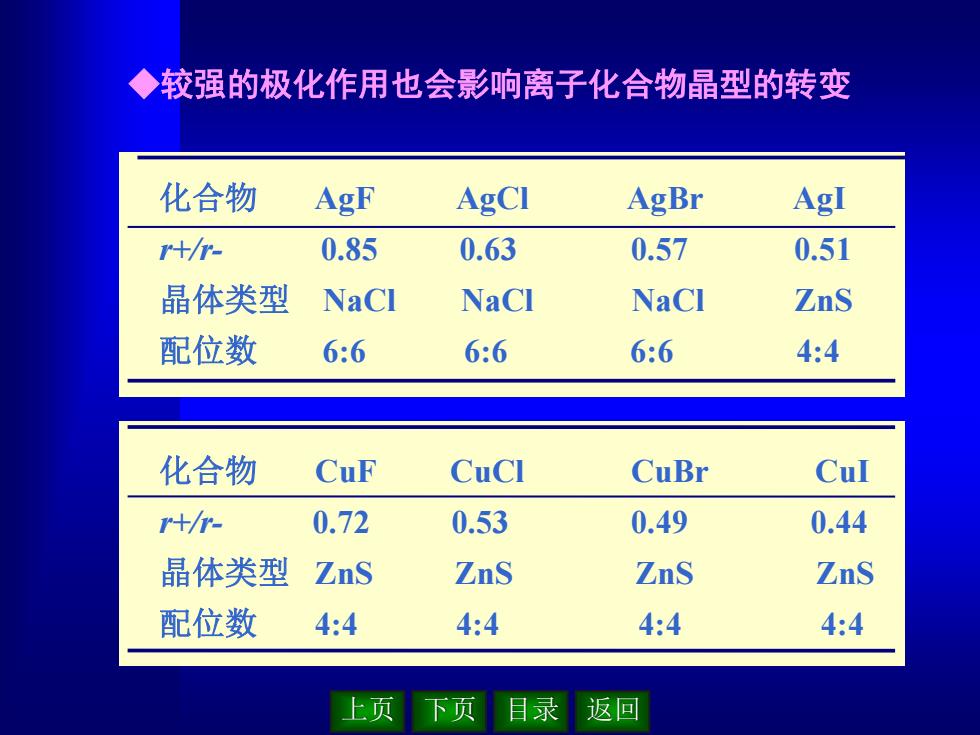
上页 下页 目录 返回 ◆较强的极化作用也会影响离子化合物晶型的转变 化合物 AgF AgCl AgBr AgI r+/r- 0.85 0.63 0.57 0.51 晶体类型 NaCl NaCl NaCl ZnS 配位数 6:6 6:6 6:6 4:4 化合物 AgF AgCl AgBr AgI r+/r- 0.85 0.63 0.57 0.51 晶体类型 NaCl NaCl NaCl ZnS 配位数 6:6 6:6 6:6 4:4 化合物 CuF CuCl CuBr CuI r+/r- 0.72 0.53 0.49 0.44 晶体类型 ZnS ZnS ZnS ZnS 配位数 4:4 4:4 4:4 4:4 化合物 CuF CuCl CuBr CuI r+/r- 0.72 0.53 0.49 0.44 晶体类型 ZnS ZnS ZnS ZnS 配位数 4:4 4:4 4:4 4:4
上页 下页 目录 返回 ◆较强的极化作用也会影响离子化合物晶型的转变 化合物 AgF AgCl AgBr AgI r+/r- 0.85 0.63 0.57 0.51 晶体类型 NaCl NaCl NaCl ZnS 配位数 6:6 6:6 6:6 4:4 化合物 AgF AgCl AgBr AgI r+/r- 0.85 0.63 0.57 0.51 晶体类型 NaCl NaCl NaCl ZnS 配位数 6:6 6:6 6:6 4:4 化合物 CuF CuCl CuBr CuI r+/r- 0.72 0.53 0.49 0.44 晶体类型 ZnS ZnS ZnS ZnS 配位数 4:4 4:4 4:4 4:4 化合物 CuF CuCl CuBr CuI r+/r- 0.72 0.53 0.49 0.44 晶体类型 ZnS ZnS ZnS ZnS 配位数 4:4 4:4 4:4 4:4

上页 下页 目录 返回 可用离子极化观点解释。 ●为什么下列各物质溶解度依次减小, 颜色逐渐加深? AgF(白色) AgCl(白色) AgBr(淡黄色) AgI(黄色) ●为什么Na2S易溶于水,ZnS难溶于水? Question 1 Solution
上页 下页 目录 返回 可用离子极化观点解释。 ●为什么下列各物质溶解度依次减小, 颜色逐渐加深? AgF(白色) AgCl(白色) AgBr(淡黄色) AgI(黄色) ●为什么Na2S易溶于水,ZnS难溶于水? Question 1 Solution

上页 下页 目录 返回 2.2.2 离子的特征 离子键 的强度 正、负离 子的性质 离子化合 物的性质 取决于 取 决 于 1. 离子电荷 (charge) ◆ 正离子通常只由金属原子形成,其电荷等于中性原 子失去电子数目。 ◆ 负离子通常只由非金属原子组成,其电荷等于中性 原子获得电子的数目;出现在离子晶体中的负离子 还可以是多原子离子 (SO4 2− )
上页 下页 目录 返回 2.2.2 离子的特征 离子键 的强度 正、负离 子的性质 离子化合 物的性质 取决于 取 决 于 1. 离子电荷 (charge) ◆ 正离子通常只由金属原子形成,其电荷等于中性原 子失去电子数目。 ◆ 负离子通常只由非金属原子组成,其电荷等于中性 原子获得电子的数目;出现在离子晶体中的负离子 还可以是多原子离子 (SO4 2− )

上页 下页 目录 返回 2. 离子半径 (radius) ◆严格讲,离子半径无法确定 (电子云无明确边界) ◆核间距(nuclear separation) 的一半 ◆关键是如何分割(X射线衍射 法) ◆三套数据,使用时应是自洽的 ◆推荐使用R. D. Shanon半径数据 (考虑到配位数的影响) 副篇内容 离子半径随 配位数的变化
上页 下页 目录 返回 2. 离子半径 (radius) ◆严格讲,离子半径无法确定 (电子云无明确边界) ◆核间距(nuclear separation) 的一半 ◆关键是如何分割(X射线衍射 法) ◆三套数据,使用时应是自洽的 ◆推荐使用R. D. Shanon半径数据 (考虑到配位数的影响) 副篇内容 离子半径随 配位数的变化