
思考题 1.关于等电子体,下列说法正确的是: A. N20、N3、NO2、CO2互为等电子体; B. B0,3-、C032、P033、Si044互为等电子体; C. C02、NO2互为等电子体; D. C02、N20、N3+、N02互为等电子体。 A 2.03中存在 键和 键,0-0键长界于 和 之间。 3.0-0单键键能 S-S单键键能; 0-0双键键能 S-S双键键能; O容易形成 键,S易形成 键
1. 关于等电子体,下列说法正确的是: A. N2O、N3 - 、NO2 + 、 CO2 互为等电子体; B. BO3 3- 、 CO3 2-、 PO3 3- 、 SiO4 4-互为等电子体; C. CO2 、 NO2 -互为等电子体; D. CO2 、 N2O、 N3 + 、NO2 -互为等电子体。 A 2. O3中存在 键和 键,O-O 键长界于 和 之间。 3. O-O单键键能 S-S单键键能; O-O双键键能 S-S双键键能; O容易形成 键,S易形成 键。 思考题
臭氧(O3)的生成和制备 3 方电 液化分离提纯 1<242nm 02+03 302+hV220-330nm 203 臭氧发生器示意图 平流层(20~40km):030.2ppm,可吸收5%紫外线 制冷剂氟利昂(一种氟氯代烃)放出的C1是O3分解的催 化剂,对破坏臭氧层有长期的作用。 1995年度Nobel化学奖
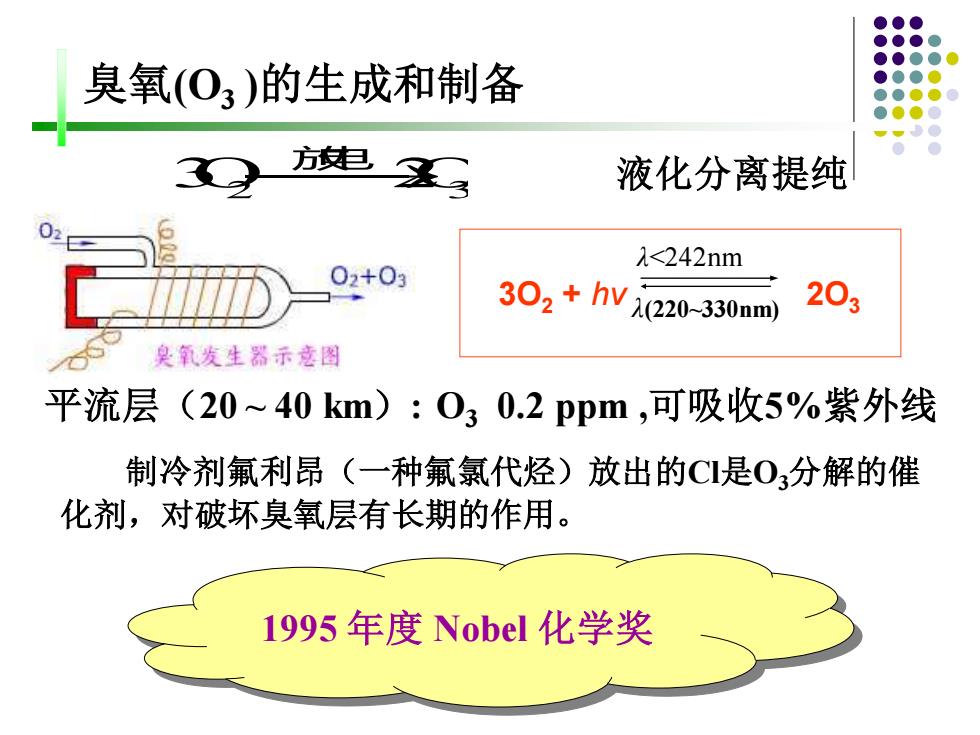
臭氧(O3 )的生成和制备 λ<242nm 3O2 + hν λ(220~330nm) 2O3 平流层(20 ~ 40 km): O3 0.2 ppm ,可吸收5%紫外线 3O2 ⎯→2O3 放电 液化分离提纯 制冷剂氟利昂(一种氟氯代烃)放出的Cl是O3分解的催 化剂,对破坏臭氧层有长期的作用。 1995 年度 Nobel 化学奖

hv CF2CL CF2CI+CI C.+03一 CI0.+02 C10.+0一 C1+02 N0+O3→NO2+O2 2 20 NO2+0→N0+O2 '0o 净反应:03+0=202
hν CF2Cl2 CF2Cl + Cl• Cl• + O3 ClO• + O2 ClO• + O Cl• + O2 NO + O3 → NO2 + O2 NO2 + O → NO + O2 净反应:O3 + O = 2O2

(3)03化学性质: 强氧化性 ①分子结构Π4 03+e=03 π3+e→兀 例如:KO3,NH4O3 03+2e=032 「2大π键打开,形成臭氧链: (一0-0一0一)2
分子结构 3 4 3 4 + → 6 3 2e O3 + 2e = O3 2 ― ,大π键打开,形成臭氧链: (―O―O―O―)2― (3) O3化学性质: 强氧化性 5 3 4 3 3 3 π e π O e O + → + = − 例如:KO3,NH4O3

例:a.油画处理: PbS(s)+303(g)=PbSO4()+02(g) 黑 白 b.含氰废水处理: CN-+O3=0CN-+O2↑ 20CN-+303=C032-+C02↑+N2↑+302↑ c.O3的定量分析(碘量法): KI+O3(g)+H20=2+2K0H+02(g) I2+2S2032=2+S4062-(连四硫酸根)
例: a. 油画处理: PbS(S) + 3O3(g) = PbSO4(s) + O2(g) 黑 白 b. 含氰废水处理: CN― + O3 = OCN― + O2↑ 2OCN― + 3O3 = CO3 2― + CO2↑+ N2↑+3O2↑ c. O3的定量分析(碘量法): KI + O3 (g) + H2O = I2 + 2KOH + O2 (g) I2 + 2S2O3 2- = 2I-+ S4O6 2― (连四硫酸根)