
四、过程与途径 系统状态发生的一切变化称为过程。按照系统 中物质变化前后的状态过程可分为简单状态变化过 程、相变过程和化学变化过程。 系统从一始态到一终态经由不同的方式,称 为不同的途径,即变化的具体步骤。 11
11 系统状态发生的一切变化称为过程。按照系统 中物质变化前后的状态过程可分为简单状态变化过 程、相变过程和化学变化过程。 四、过程与途径 系统从一始态到一终态经由不同的方式,称 为不同的途径,即变化的具体步骤
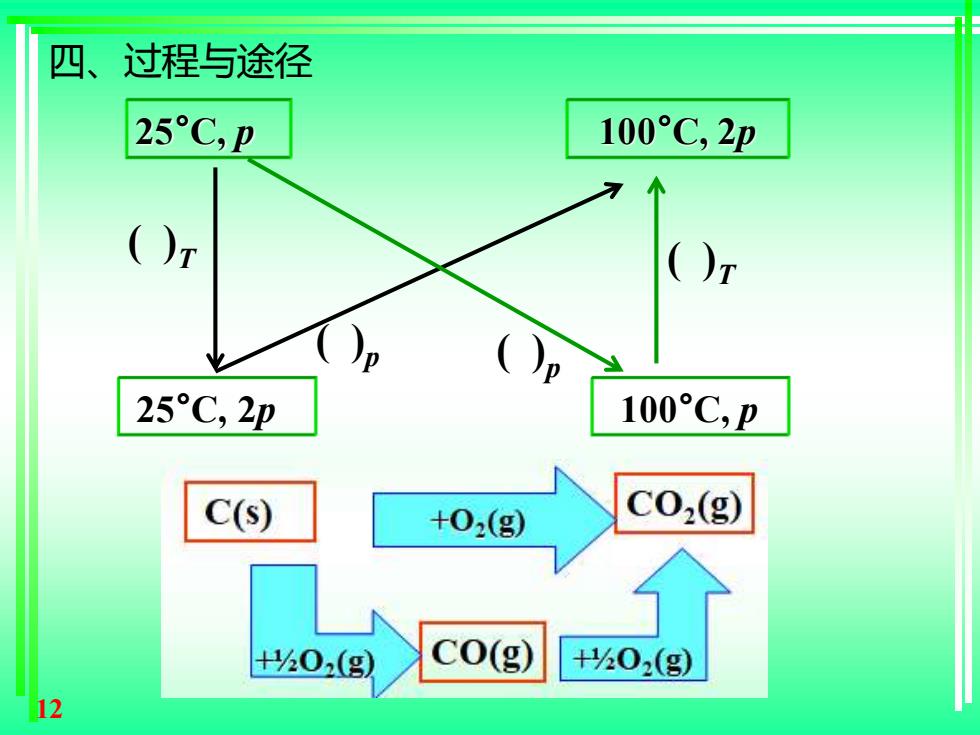
四、 过程与途径 25°C,p 100°C,2p ()r ()r 25C,2p 100°C,p C(s) +02(g) C02(g) +0(g) C0(g) +h02(g) 12
12 25°C, p 100°C, 2p 25°C, 2p 100°C, p ( )T ( )T ( )p ( )p 四、过程与途径

五、热力学平衡 系统与环境间无物质、能量的交换,系统各状 态性质均不随时间而变化时,称系统处于热力学平 衡状态。 1.热平衡:thermal equilibrium 无绝热壁存在下,系统中各部分温度相同。 2.机械平衡:mechanical equilibrium 系统中无刚壁存在时,系统中压力相同。 3.化学平衡:chemical equilibrium 系统中无化学变化阻力存在时,系统的组成不随时间 变化。 4. 相平衡:phase equilibrium 系统中各相的数量和组成不随时间变化 13
13 五、热力学平衡 系统与环境间无物质、能量的交换,系统各状 态性质均不随时间而变化时,称系统处于热力学平 衡状态。 1. 热平衡:thermal equilibrium 无绝热壁存在下,系统中各部分温度相同。 2. 机械平衡:mechanical equilibrium 系统中无刚壁存在时,系统中压力相同。 3. 化学平衡:chemical equilibrium 系统中无化学变化阻力存在时,系统的组成不随时间 变化。 4. 相平衡:phase equilibrium 系统中各相的数量和组成不随时间变化

§1.3能量守恒热力学第一定律 Conservation of Energy 14
14 §1.3能量守恒⎯热力学第一定律 Conservation of Energy

一、能量守恒原理 能量守恒原理:自然界中的一切物质都具有能量,能量不能被 创造,也不能无形消失;但能量可以从一种形态转换成另一种 形态,且在能量的转换过程中能量总量不变。能量守恒原理是 人们长期经验的总结。 能量守恒原理的科学证明: 1840年左右,Joule和nayer做了20多年的大量实验后,得到了 著名的热功当量:1cal=4.184J和1J=0.239cal。 15
15 能量守恒原理:自然界中的一切物质都具有能量,能量不能被 创造,也不能无形消失;但能量可以从一种形态转换成另一种 形态,且在能量的转换过程中能量总量不变。能量守恒原理是 人们长期经验的总结。 能量守恒原理的科学证明: 1840年左右, Joule和mayer 做了20多年的大量实验后,得到了 著名的热功当量:1 cal = 4.184 J和 1J = 0.239 cal 。 一、能量守恒原理