在含有少量Sn2+离子FeS04溶液|控制酸度法 络合掩蔽法 离子交换法 氧化还原掩蔽 D 4 中,用K2C207法滴定Fe2+,应先 法 消除Sn2+的干扰,宜釆用()。 45用Ce4艹标准溶液滴定Fe2*离子, pH玻璃电极 银电极 氟离子选择电极 铂电极 D 应选用()作指示电极。 46 原子吸收方法测定中,通过改变 分子吸收 背景吸收 光谱干扰 基体干扰 C 狭缝宽度,可消除下列哪种干扰 ()。 47 测定有机化合物中的硫,可用氧 水溶液 80%乙醇溶液 三氯甲烷溶液 冰乙酸溶液 B 瓶法分解试样,使硫转化为硫的 氧化物,并在过氧化氢溶液中转 化为S042,然后用吐啉作指示 剂,BaC2标准溶液作滴定剂,在 ( )介质中直接滴定。 恒电流库仑装置中,发生系统的 指示电极 辅助电极 参比电极 复合电极 B 作用是提供一个数值已知的恒电 8 流,产生滴定剂并准确记录电解 时间,它是由一个工作电极和 ( )组成。 49用0.1mol/L NaOH滴定0.1mol/L 6.7-8.7 6.7-9.7 8.7~10.7 7.7~10.7 B HAc(pKa=4.7)时的pH突跃范围为 7.7~9.7,由此可以推断用0.1 mol/L NaOH滴定pKa为3.7的0.l mo/L某一元酸的pH突跃范围为 ()
4 4 在含有少量 Sn2+离子 FeSO4溶液 中,用 K2Cr2O7法滴定 Fe2+,应先 消除 Sn2+的干扰,宜釆用( ) 。 控制酸度法 络合掩蔽法 离子交换法 氧化还原掩蔽 法 D 45 用 Ce4+标准溶液滴定 Fe2+离子, 应选用( )作指示电极。 pH 玻璃电极 银电极 氟离子选择电极 铂电极 D 46 原子吸收方法测定中,通过改变 狭缝宽度,可消除下列哪种干扰 ( )。 分子吸收 背景吸收 光谱干扰 基体干扰 C 47 测定有机化合物中的硫,可用氧 瓶法分解试样,使硫转化为硫的 氧化物,并在过氧化氢溶液中转 化为 SO4 2-,然后用吐啉作指示 剂,BaCl2标准溶液作滴定剂,在 ( )介质中直接滴定。 水溶液 80%乙醇溶液 三氯甲烷溶液 冰乙酸溶液 B 4 8 恒电流库仑装置中,发生系统的 作用是提供一个数值已知的恒电 流,产生滴定剂并准确记录电解 时间,它是由一个工作电极和 ( )组成。 指示电极 辅助电极 参比电极 复合电极 B 49 用 0.1 mol/L NaOH 滴定 0.1 mol/L HAc (pKa=4.7)时的 pH 突跃范围为 7.7~9.7,由此可以推断用 0.1 mol/L NaOH 滴定 pKa为 3.7 的 0.1 mol/L 某一元酸的 pH 突跃范围为 ( )。 6.7~8.7 6.7~9.7 8.7~10.7 7.7~10.7 B
50 在一般情况下,只要两电对的电 E1-E2≥0.30V E1-E2≤0.30V E1-E2≥0.40V E1-E2≤0.40V C 极电位之差超过(),该氧化还原 反应就可用于滴定分析。 51 使用电光天平时,标尺刻度模 物镜焦距不对 盘托过高 天平放置不水平 重心砣位置不 A 糊,这可能是因为()。 合适 反应式 H2O2 H2SO4 KMnO4 MnSO4 52 2KMn04+3H2SO4+5H2O2=K2S04+ 2MnS04+502+8H20中,氧化剂是 () 53 反应A(气)+2B(气),→2C 使用催化剂 升高温度 增大A的浓度 增大容器的体 C (气)+2D(固)+Q,达到平 积 衡后,要使V正反应加快,平衡 向右移动,可以采取的措施是 ( )。 54 原子吸收分光光度计的核心部分 光源 原子化器 分光系统 检测系统 B 是()。 55 气相色谱仪除了载气系统、柱分 恒温系统 检测系统 记录系统 样品制备系统 B 离系统、进样系统外,其另外一 个主要系统是()。 在稀溶液凝固点降低公式△ 溶质的质量摩尔 溶质的摩尔分数 溶剂的摩尔分数 溶质的体积摩 A 5 T=krm中,m所代表的是溶液中 浓度 尔浓度 6 ()。 57 下列有关分析天平性能或使用方 分析天平的灵敏 分析天平的零点是 某坩埚的质量为 用全自动电光 D 法的说法正确的是()。 度越高越好 天平达到平衡时的 15.4613克,则用 天平直接称量 读数 1克以上的砝码组 时,投影屏读 数迅速向右偏
50 在一般情况下,只要两电对的电 极电位之差超过( ),该氧化还原 反应就可用于滴定分析。 E1-E2≥ 0.30V E1-E2≤0.30V E1-E2≥ 0.40V E1-E2≤0.40V C 51 使用电光天平时,标尺刻度模 糊,这可能是因为( )。 物镜焦距不对 盘托过高 天平放置不水平 重心砣位置不 合适 A 5 2 反应式 2KMnO4+3H2SO4+5H2O2=K2SO4+ 2MnSO4+5O2+8H2O 中,氧化剂是 ( )。 H2O2 H2SO4 KMnO4 MnSO4 C 53 反应 A(气)+2B(气)→2C (气)+2D(固)+Q,达到平 衡后,要使 V 正反应加快,平衡 向右移动,可以采取的措施是 ( )。 使用催化剂 升高温度 增大 A 的浓度 增大容器的体 积 C 54 原子吸收分光光度计的核心部分 是 ( )。 光源 原子化器 分光系统 检测系统 B 55 气相色谱仪除了载气系统、柱分 离系统、进样系统外,其另外一 个主要系统是( )。 恒温系统 检测系统 记录系统 样品制备系统 B 5 6 在稀溶液凝固点降低公式△ Tf=kf·m中,m所代表的是溶液中 ( )。 溶质的质量摩尔 浓度 溶质的摩尔分数 溶剂的摩尔分数 溶质的体积摩 尔浓度 A 57 下列有关分析天平性能或使用方 法的说法正确的是( )。 分析天平的灵敏 度越高越好 分析天平的零点是 天平达到平衡时的 读数 某坩埚的质量为 15.4613 克,则用 1 克以上的砝码组 用全自动电光 天平直接称量 时,投影屏读 数迅速向右偏 D
合就应为10,2, 转,则需减砝 2,1 码 58 欲测定SO2的准确含量,需将灼 瓷坩埚 铂坩埚 镍坩埚 刚玉坩埚 B 烧称重后的SiO2以HF处理,宜 用下列何种坩埚()。 59 二 级反应2A→B其半衰期()。 与A的起始浓度 与A的起始浓度成 与A的起始浓度 与A的起始浓 无关 正比 成反比 度平方成反比 盐酸羟胺肟化法测定羰基时,终 中性红 溴酚蓝 酚酞 亚甲基蓝 B 6 点指示剂应选()。 61 实验用水电导率的测定要注意避 氧气、减小 二氧化碳、增大 氧气、增大 二氧化碳、减 B 免空气中的()溶于水,使水的电 小 导率()。 62 在碘量法中,淀粉是专属指示 碘的颜色 I的颜色 游离碘与淀粉生成 I与淀粉生成 C 剂,当溶液呈蓝色时,这是()。 物的颜色 物的颜色 63选用$单位的倍数单位时一般使 0.1-10 0.1-100 0.1~1000 0.1-10000 C 量的数值处于()之间。 64 应该放在远离有机物及还原物质 浓硫酸 浓盐酸 浓硝酸 浓高氯酸 D 的地方,使用时不能戴橡皮手套 的是()。 金光红色标签的试剂适用范围为 精密分析实验 ·般分析实验 一般分析工作 生化及医用化 6 ()。 学实验 B 66 一化学试剂瓶的标签为绿色,其 G.R. A.R. C.P. L.P. 英文字母的缩写为()。 A 67 在分析过程中,检查有无系统误 重复 空白 对照 再现性 C 差存在,作()试验是最有效的
合就应为 10,2, 2,1 转,则需减砝 码 58 欲测定 SiO2的准确含量,需将灼 烧称重后的 SiO2以 HF 处理,宜 用下列何种坩埚( )。 瓷坩埚 铂坩埚 镍坩埚 刚玉坩埚 B 59 二级反应 2A→B 其半衰期( )。 与 A 的起始浓度 无关 与 A 的起始浓度成 正比 与 A 的起始浓度 成反比 与 A 的起始浓 度平方成反比 C 6 0 盐酸羟胺肟化法测定羰基时,终 点指示剂应选( )。 中性红 溴酚蓝 酚酞 亚甲基蓝 B 61 实验用水电导率的测定要注意避 免空气中的( )溶于水,使水的电 导率( )。 氧气、减小 二氧化碳、增大 氧气、增大 二氧化碳、减 小 B 62 在碘量法中,淀粉是专属指示 剂,当溶液呈蓝色时,这是( )。 碘的颜色 I -的颜色 游离碘与淀粉生成 物的颜色 I -与淀粉生成 物的颜色 C 63 选用 SI 单位的倍数单位时一般使 量的数值处于( )之间。 0.1~10 0.1~100 0.1~1000 0.1~10000 C 64 应该放在远离有机物及还原物质 的地方,使用时不能戴橡皮手套 的是( )。 浓硫酸 浓盐酸 浓硝酸 浓高氯酸 D 6 5 金光红色标签的试剂适用范围为 ( )。 精密分析实验 一般分析实验 一般分析工作 生化及医用化 学实验 B 66 一化学试剂瓶的标签为绿色,其 英文字母的缩写为( )。 G.R. A.R. C.P. L.P. A 67 在分析过程中,检查有无系统误 差存在,作( )试验是最有效的 重复 空白 对照 再现性 C
方法,这样可校正测试结果,消 除系统误差。 68两位分析人员对同一样品进行分 Q检验法 F检验法 格布鲁斯法 t检验法 析,得到两组数据,要判断两组 B 分析的精密度有无显著性差异, 应该用()。 用磺基水杨酸分光光度法测定 y=-0.006+ y=-0.009+ y=-0.009+ y=-0.008+ D 6 铁,得到如下数据:V(Fe) 0.0651x 0.0951x 0.0651x 0.0851x mL:0.002.004.006.00 8.0010.00A:0.0000.165 0.3120.5120.6600.854,根 据上述数据所得的回归方程为 ()。 70 以NaOH滴定H3PO4(Ka=7.5×10 4.33 12.3 9.75 7.21 3,Ka2=6.2×10-8,Ka3=5.0×10-13) C 至生成NazHPO4时,溶液的pH 应当是()。 71 物质的量浓度相同的下列阴离子 CN- S2-(KHs-=7.1×10 HCOO CH3COO B 的水溶液,()碱性最强。 (KHCN=6.2×10-10) 15,Ks=1.3×10-7 (KHC00H=1.7×104) (KHAe=1.8×105) 72 若以冰醋酸作溶剂,四种酸: 2,4,1,3 1,4,3,2 4,2,3,1 3,2,4,1 B (1)HCIO4(2)HNO3(3) HC1(4)H2S04的强度顺序应为 ( ) 在EDTA配位滴定中,酸度是影 pH愈大,酸效应 pH愈小,酸效应系 酸度愈低,酸效应 酸度愈高,酸 C 7 响配位平衡的主要因素之一,下 系数越大,配合 数越大,配合物的 系数越小,配合物 效应系数越 列说法正确的是()。 物的稳定性愈大 稳定性愈大 的稳定性愈大 小,配合物的 稳定性愈大
方法,这样可校正测试结果,消 除系统误差。 68 两位分析人员对同一样品进行分 析,得到两组数据,要判断两组 分析的精密度有无显著性差异, 应该用( )。 Q 检验法 F 检验法 格布鲁斯法 t 检验法 B 6 9 用磺基水杨酸分光光度法测定 铁,得到如下数据: V(Fe) /mL: 0.00 2.00 4.00 6.00 8.00 10.00 A: 0.000 0.165 0.312 0.512 0.660 0.854,根 据上述数据所得的回归方程为 ( )。 y= -0.006 + 0.0651x y= -0.009 + 0.0951x y= -0.009 + 0.0651x y= -0.008 + 0.0851x D 70 以 NaOH 滴定 H3PO4(Ka1=7.5×10- 3, Ka2=6.2×10-8, Ka3=5.0×10-13) 至生成 Na2HPO4时,溶液的 pH 应当是( )。 4.33 12.3 9.75 7.21 C 71 物质的量浓度相同的下列阴离子 的水溶液,( )碱性最强。 CN - (KHCN=6.2×10-10) S 2- (KHS-=7.1×10- 15,KH2S=1.3×10-7 ) HCOO- (KHCOOH=1.7×10-4 ) CH3COO- (KHAc=1.8×10-5 ) B 72 若以冰醋酸作溶剂,四种酸: (1)HClO4 (2)HNO3 (3) HCl (4)H2SO4的强度顺序应为 ( )。 2,4,1,3 1,4,3,2 4,2,3,1 3,2,4,1 B 7 3 在 EDTA 配位滴定中,酸度是影 响配位平衡的主要因素之一,下 列说法正确的是( )。 pH 愈大,酸效应 系数越大,配合 物的稳定性愈大 pH 愈小,酸效应系 数越大,配合物的 稳定性愈大 酸度愈低,酸效应 系数越小,配合物 的稳定性愈大 酸度愈高,酸 效应系数越 小,配合物的 稳定性愈大 C
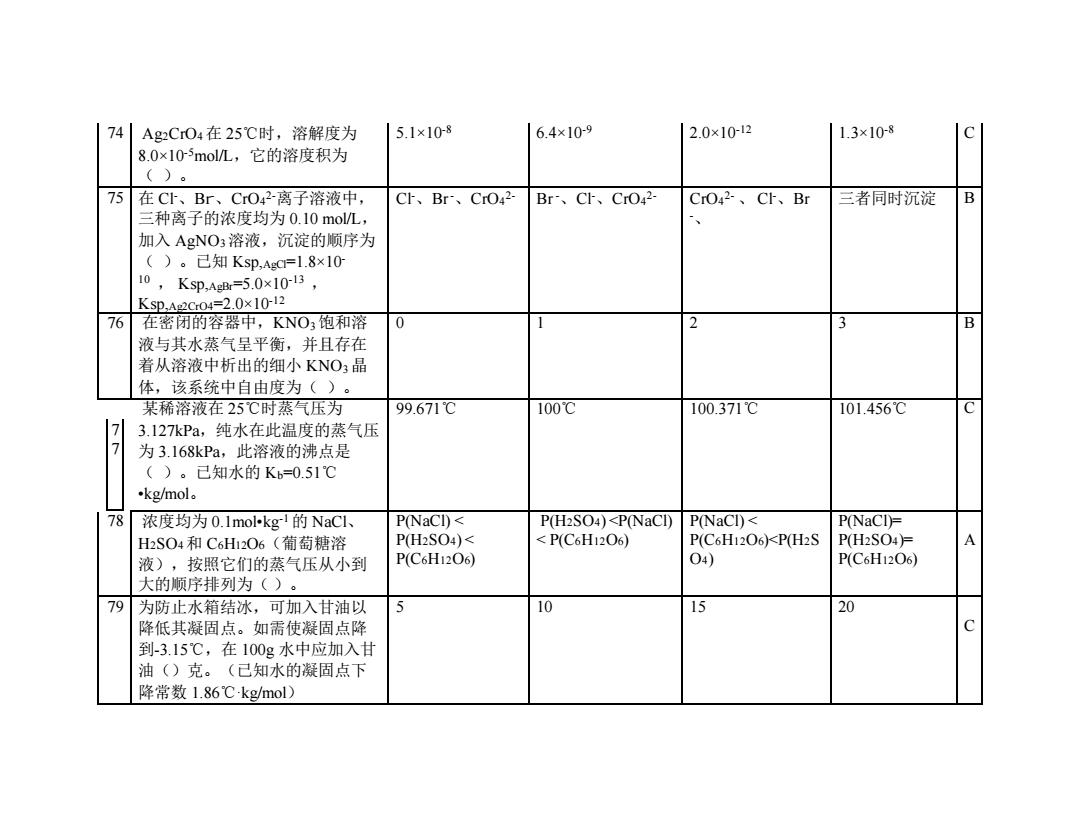
741 Ag2CO4在25℃时,溶解度为 5.1×10-8 6.4×109 2.0×10-12 1.3×10-8 8.0×105molL,它的溶度积为 ()。 75 在CI、Br、CrO42-离子溶液中, CI、Br、CrO42- Br、CI、CrO42- CrO42-、C、Br 三者同时沉淀 B 三种离子的浓度均为0.10mo/L, 加入AgNO3溶液,沉淀的顺序为 ()。己知Ksp,AgC=1.8×10 10, Ksp,AgB=5.0x10-13, KSp,A2C04=2.0×10-12 76 在密闭的容器中,KNO3饱和溶 0 2 3 B 液与其水蒸气呈平衡,并且存在 着从溶液中析出的细小KNO3晶 体,该系统中自由度为()。 某稀溶液在25℃时蒸气压为 99.671℃ 100℃ 100.371℃ 101.456℃ C 7 3.127kPa,纯水在此温度的蒸气压 7 为3.168kPa,此溶液的沸点是 ()。已知水的Kb=0.51℃ .kg/mol. 78 浓度均为0.1mol-kg的NaC P(NaCl)< P(H2SO4)<P(NaCl) P(NaCl)< P(NaCI)= H2S04和C6H12O6(葡萄糖溶 P(H2SO4)< <P(C6H12O6) P(C6H12O6)<P(H2S P(H2SO4= A 液),按照它们的蒸气压从小到 P(C6H12O6) O4) P(C6H12O6) 大的顺序排列为()。 79 为防止水箱结冰,可加入甘油以 5 10 15 20 降低其凝固点。如需使凝固点降 C 到-3.15℃,在100g水中应加入甘 油()克。(己知水的凝固点下 降常数1.86℃-kg/mol)
74 Ag2CrO4在 25℃时,溶解度为 8.0×10-5mol/L,它的溶度积为 ( )。 5.1×10-8 6.4×10-9 2.0×10-12 1.3×10-8 C 75 在 Cl-、Br-、CrO4 2-离子溶液中, 三种离子的浓度均为 0.10 mol/L, 加入 AgNO3溶液,沉淀的顺序为 ( )。已知 Ksp,AgCl=1.8×10- 10 , Ksp,AgBr=5.0×10-13 , Ksp,Ag2CrO4=2.0×10-12 Cl-、Br-、CrO4 2- Br-、Cl-、CrO4 2- CrO4 2- 、 Cl-、Br -、 三者同时沉淀 B 76 在密闭的容器中,KNO3饱和溶 液与其水蒸气呈平衡,并且存在 着从溶液中析出的细小 KNO3晶 体,该系统中自由度为( )。 0 1 2 3 B 7 7 某稀溶液在 25℃时蒸气压为 3.127kPa,纯水在此温度的蒸气压 为 3.168kPa,此溶液的沸点是 ( )。已知水的 Kb=0.51℃ •kg/mol。 99.671℃ 100℃ 100.371℃ 101.456℃ C 78 浓度均为 0.1mol•kg-1的 NaCl、 H2SO4和 C6H12O6(葡萄糖溶 液),按照它们的蒸气压从小到 大的顺序排列为( )。 P(NaCl) < P(H2SO4) < P(C6H12O6) P(H2SO4) <P(NaCl) < P(C6H12O6) P(NaCl) < P(C6H12O6)<P(H2S O4) P(NaCl)= P(H2SO4)= P(C6H12O6) A 79 为防止水箱结冰,可加入甘油以 降低其凝固点。如需使凝固点降 到-3.15℃,在 100g 水中应加入甘 油()克。(已知水的凝固点下 降常数 1.86℃·kg/mol) 5 10 15 20 C