
补:Na+、K+、Mg+是产生咸味的主要阳离 子,阴离子则影响咸味强弱,C为主。 NaCI纯咸味,KCI、MgCI2、MgSO4苦味 依次增强。 二、卤秦单质 1.X2的物理性质 2.X2的化学性质 2024/7/25 6
2024/7/25 6 补:Na+ 、K+ 、Mg2+是产生咸味的主要阳离 子,阴离子则影响咸味强弱,CI为主。 NaCI纯咸味,KCI、MgCI2、MgSO4苦味 依次增强。 1.X2的物理性质 2.X2的化学性质
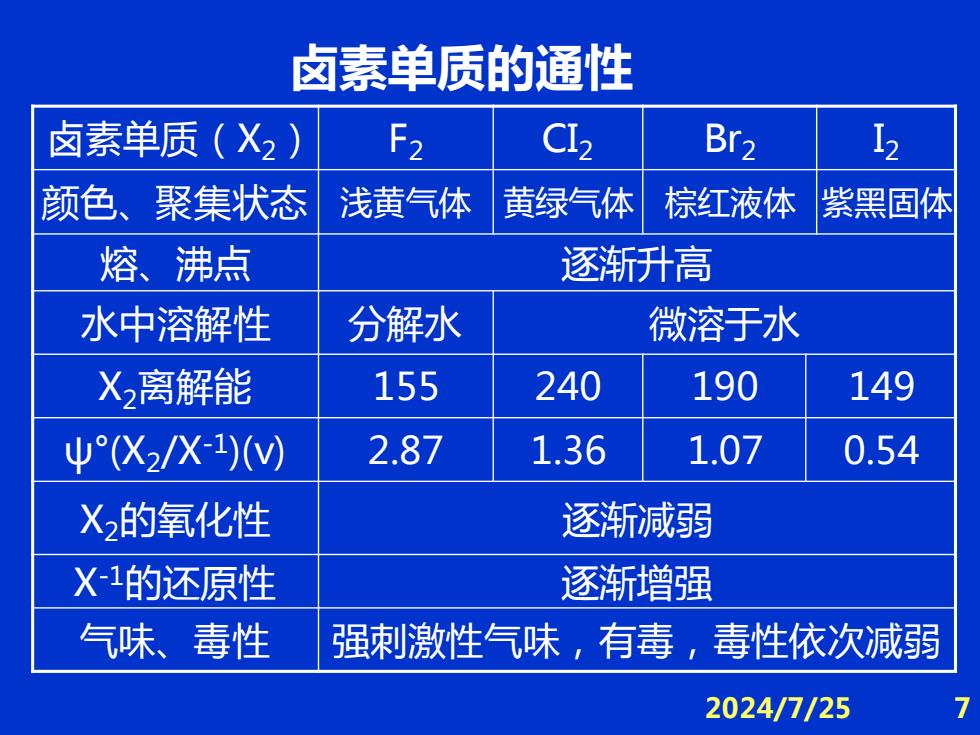
卤素单质的通性 卤素单质(X2) F2 C12 Br2 12 颜色、聚集状态 浅黄气体 黄绿气体 棕红液体 紫黑固体 熔、沸点 逐渐升高 水中溶解性 分解水 微溶于水 X2离解能 155 240 190 149 ψ°(X2/X1)V) 2.87 1.36 1.07 0.54 X2的氧化性 逐渐减弱 X1的还原性 逐渐增强 气味、毒性 强刺激性气味,有毒,毒性依次减弱 2024/7/25
2024/7/25 7 卤素单质(X2) F2 CI2 Br2 I2 颜色、聚集状态 浅黄气体 黄绿气体 棕红液体 紫黑固体 熔、沸点 逐渐升高 水中溶解性 分解水 微溶于水 X2离解能 155 240 190 149 ψ°(X2 /X-1 )(v) 2.87 1.36 1.07 0.54 X2的氧化性 逐渐减弱 X-1的还原性 逐渐增强 气味、毒性 强刺激性气味,有毒,毒性依次减弱 卤素单质的通性
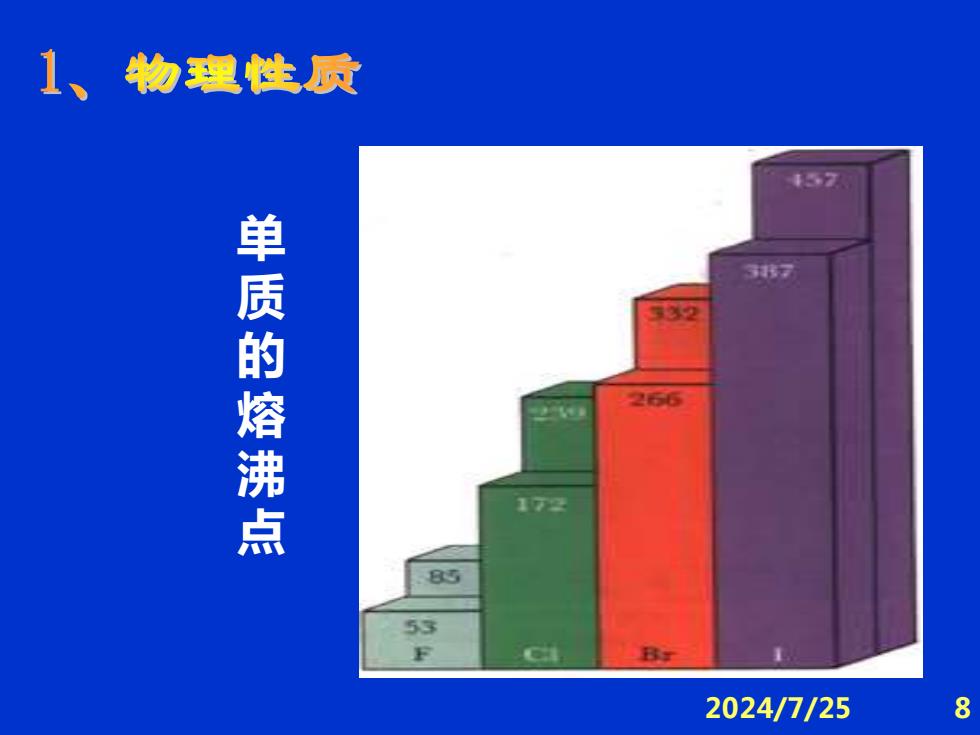
1、物理性质 457 伟万 单质的熔沸点 2 172 B 2024/7/25 8
2024/7/25 8 单质的熔沸点

①物理性质变化规律解释 X,为非极性分子,分子间作用力 熔沸点F2→12依次升高。 聚集态F2(g)→CI(g)→Br2)→I2(s) Br2:非金属中的唯一液体 12:固体易升华,紫黑→粉红 2024/7/25 9
2024/7/25 9 ①物理性质变化规律解释 X2为非极性分子,分子间作用力 ∴熔沸点F2→I2 依次升高。 聚集态F2 (g) →CI(g)→Br2 (l)→I2 (s) Br2:非金属中的唯一液体 I2:固体易升华,紫黑→粉红

当可见光照射到物体上时,物体所显颜色 就是未被吸收光的复合色。 卤素分子轨道能级图 ()2()2()(p)()mp) 卷发→(cs)2(Gs)2(0p)P(p)4(元p)3(G^p) 随卤素原子序数的增加,核对外层电子的 引力依次减弱,激发电子所需能量依次降低。 2024/7/25 10
2024/7/25 10 随卤素原子序数的增加,核对外层电子的 引力依次减弱,激发电子所需能量依次降低。 1 np 3 * np 4 * np 2 np 2 ns 2 * ns np 4 * np 4 * np 2 np 2 ns 2 * ns ) ) ) ( ) ( ) ( ) ) ) ) ( ) ( ) ( ) ( ( ( ( ( ( ⎯激 发 ⎯→ 当可见光照射到物体上时,物体所显颜色 就是未被吸收光的复合色。 卤素分子轨道能级图