
§14-2 铬和锰 概述 Cr Mn 价电子层结构 3d54s1 3d54s2 主氧化数 +2,+3,+6 +2,+3,+4,+6,+7 元素的电势图 2024-7-25 11
2024-7-25 11 §14-2 铬和锰 概述 Cr Mn 价电子层结构 3d54s1 3d54s2 主氧化数 +2,+3,+6 +2,+3,+4,+6,+7

铬元素电势图 b81C13033 C3+-0t打 C5+-0 C /CrO:013 Cr(OL1Cr(OH):14 Cr =酸性溶液中:Cr02具有强氧化性,Cr3+最 稳定,Cr2+最不稳定,易被氧化。 碱性溶液中:Cr042最稳定,Cr(II)易被氧化. 2024-7-25 12
2024-7-25 12 铬元素电势图 酸性溶液中:Cr2O7 2-具有强氧化性, Cr3+最 稳定,Cr2+最不稳定,易被氧化。 碱性溶液中:CrO4 2-最稳定,Cr(Ⅲ)易被氧化. Cr - 1.4 Cr(OH) - 1.1 Cr(OH) - 0.13 /CrO 4 2 2 B 4 Cr - 0.91 Cr - 0.41 Cr 1.33 / Cr O 2 3 2 A 2 7
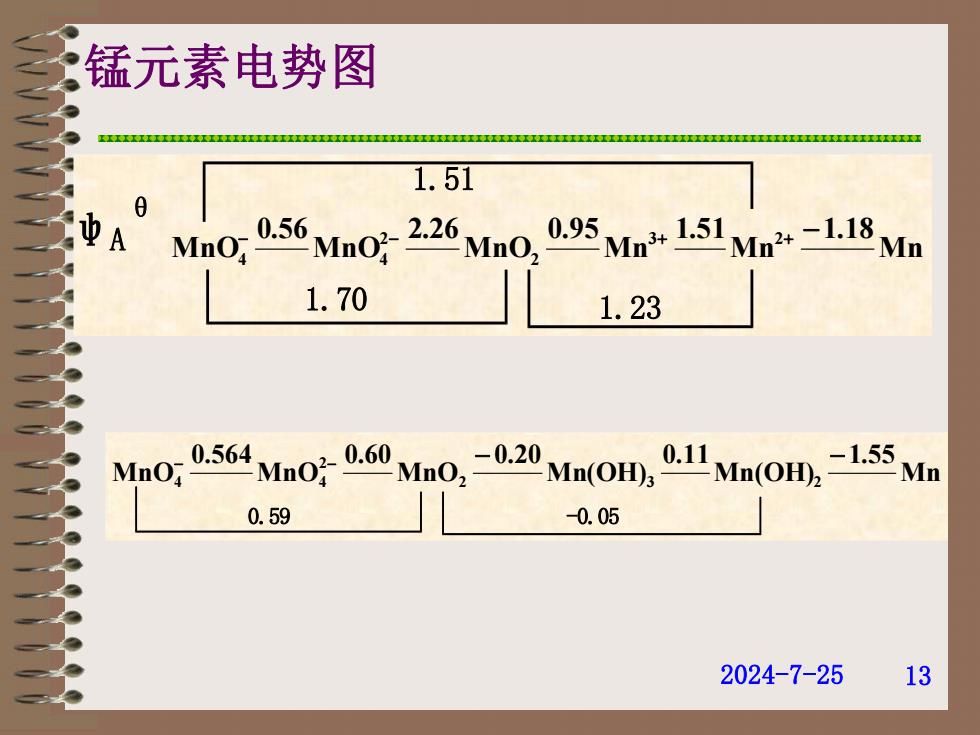
锰元素电势图 1.51 A MnO:056 MnO-226 MmO,0.95 Mn151 Mm 1.70 1.23 MnO; 0-564Mn0g0.60Mn0,-0.20Mn(OH,01 Mn(OH,)-1.55 Mn 0.59 -0.05 2024-7-25 13
2024-7-25 13 Mn 1.18 Mn 1.51 Mn 0.95 MnO 2.26 MnO 0.56 MnO 3 2 2 2 4 4 1.70 1.23 1.51 ψA θ Mn 1.55 Mn(OH) 0.11 Mn(OH) 0.20 MnO 0.60 MnO 0.564 MnO 2 3 2 2 4 4 0.59 -0.05 锰元素电势图

一、铬和锰单质的性质及用途 1.革质的物理性质 银白色金属,熔沸点高 Cr:所有金属中硬度最大, 2.单质的化学性质 Cr常温稳定(氧化膜),纯态活泼,Mn的化学 性质比较活泼 Cr+2HCI=H2↑+CrCI2(兰色,不稳定) 4Cr2+4H+02=2H20+4Cr3+(绿色,稳定) Cr在浓硝酸、王水中钝化 2024-7-25
2024-7-25 14 一 、铬和锰单质的性质及用途 1.单质的物理性质 银白色金属,熔沸点高. Cr:所有金属中硬度最大, 2.单质的化学性质 Cr常温稳定(氧化膜),纯态活泼,Mn的化学 性质比较活泼 Cr+2HCI= H2↑+CrCI2(兰色,不稳定) 4Cr2++4H++O2= 2H2O+4Cr3+(绿色,稳定) Cr在浓硝酸、王水中钝化

二、 铬的重要化合物 (一).Cr(Ⅲ)的化合物 Cr203 Cr(OH)3 Cr3+ Cr (OH)4 (1)Cr203 绿色固体,“铬绿”,微溶于水,熔点高,稳定性 高,性质类同AI203 Cr203+6Ht=2Cr3+3H20 Cr203+20H+3H20=2Cr(0H)4 制备:(NH4)2Cr202=N2+Cr203+4H20 2024-7-25 15
2024-7-25 15 二、铬的重要化合物 (一).Cr(Ⅲ)的化合物 Cr2O3 Cr(OH)3 Cr 3+ Cr(OH)4 - ⑴ Cr2O3 绿色固体, “铬绿” ,微溶于水,熔点高,稳定性 高,性质类同AI2O3 Cr2O3+6H+=2Cr3++3H2O Cr2O3+2OH-+3H2O=2Cr(OH)4 - 制备:(NH4)2Cr2O7=N2+Cr2O3+4H2O