
§9-2.弱电解质的电离平衡
§9-2.弱电解质的电离平衡

一水的电离平衡 1.水的离子积常数 H,0(I)=(aq)+0H(aq) K=[H][O] 式中的K称为水的离子积常数,经常用w表 示。Kw是标准平衡常数,式中的浓度都是相 对浓度。由于本章中使用标准浓度极其频繁, 故省略除以的写法。要注意它的实际意义。 H,O=H++OH △H>0吸热反应
一.水的电离平衡 1. 水的离子积常数 式中的 K 称为水的离子积常数,经常用 Kw 表 示。Kw 是标准平衡常数,式中的浓度都是相 对浓度。由于本章中使用标准浓度极其频繁, 故省略除以的写法。要注意它的实际意义。 H2O = H+ + OH- △ H > 0 吸热反应
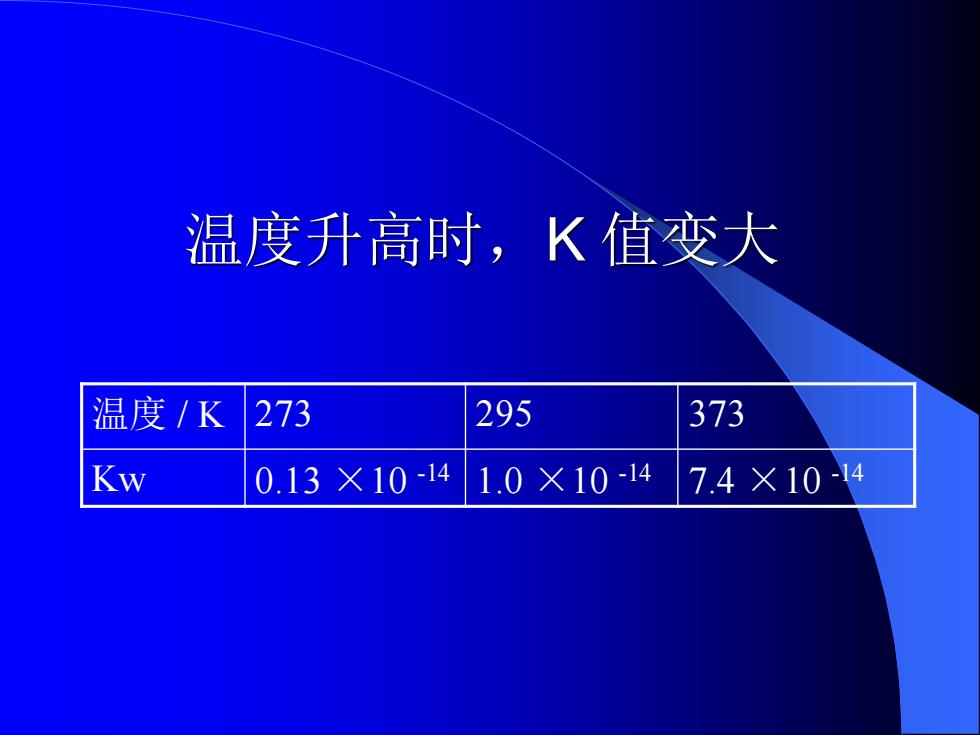
温度升高时,K值变大 温度/K 273 295 373 Kw 0.13×10-14 1.0×10-14 7.4×10-14
温度升高时,K 值变大 温度 / K 273 295 373 Kw 0.13 ×10 -14 1.0 ×10 -14 7.4 ×10 -14

二弱酸和弱减的电离平衡 。1电离平衡常数 将醋酸的分子式简写成HAc,用Ac 代表醋酸根,则醋酸的电离平衡可以表示 成:HAc=H+Ac醋酸的电离平衡常数 表示为 [H+][Ac-] K2=1.8×10-5 [HA.]
二 弱酸和弱减的电离平衡 ⚫ 1 电离平衡常数 将醋酸的分子式简写成 HAc , 用 Ac- 代表醋酸根 , 则醋酸的电离平衡可以表示 成:HAc = H+ + Ac-,醋酸的电离平衡常数 表示为

。平衡常数表示处于平衡状态的几种物质的浓度 关系,确切地说是活度的关系。但是在我们的 计算中,近似地认为活度系数f=1,即用浓度 代替活度。KaKb,的大小可以表示弱酸和弱 碱的离解程度,K的值越大,则弱酸和弱碱的 电离程度越大。 2关于电离平衡的计算 例1.已知HF的Ka=6.6×10-14,求0.01的H 溶液的[H]
⚫ 平衡常数表示处于平衡状态的几种物质的浓度 关系,确切地说是活度的关系。但是在我们的 计算中,近似地认为活度系数 f = 1,即用浓度 代替活度。 Ka Kb, 的大小可以表示弱酸和弱 碱的离解程度,K 的值越大,则弱酸和弱碱的 电离程度越大。 2 关于电离平衡的计算 例 1. 已知 HF 的 Ka = 6.6 ×10 -14 ,求 0.01 的 HF 溶液的 [ H+ ]