
吸收光谱与发射光谱 原子受到激发后,会发光,光谱由其特性 决定 ·原子也会吸收光,从而在透射光谱中出现 一系列的暗线 ·吸收光谱与发射光谱是对应的 氢原子的发射光谱 氢原子的吸收光谱
吸收光谱与发射光谱 • 原子受到激发后,会发光,光谱由其特性 决定 • 原子也会吸收光,从而在透射光谱中出现 一系列的暗线 • 吸收光谱与发射光谱是对应的 氢原子的发射光谱 氢原子的吸收光谱
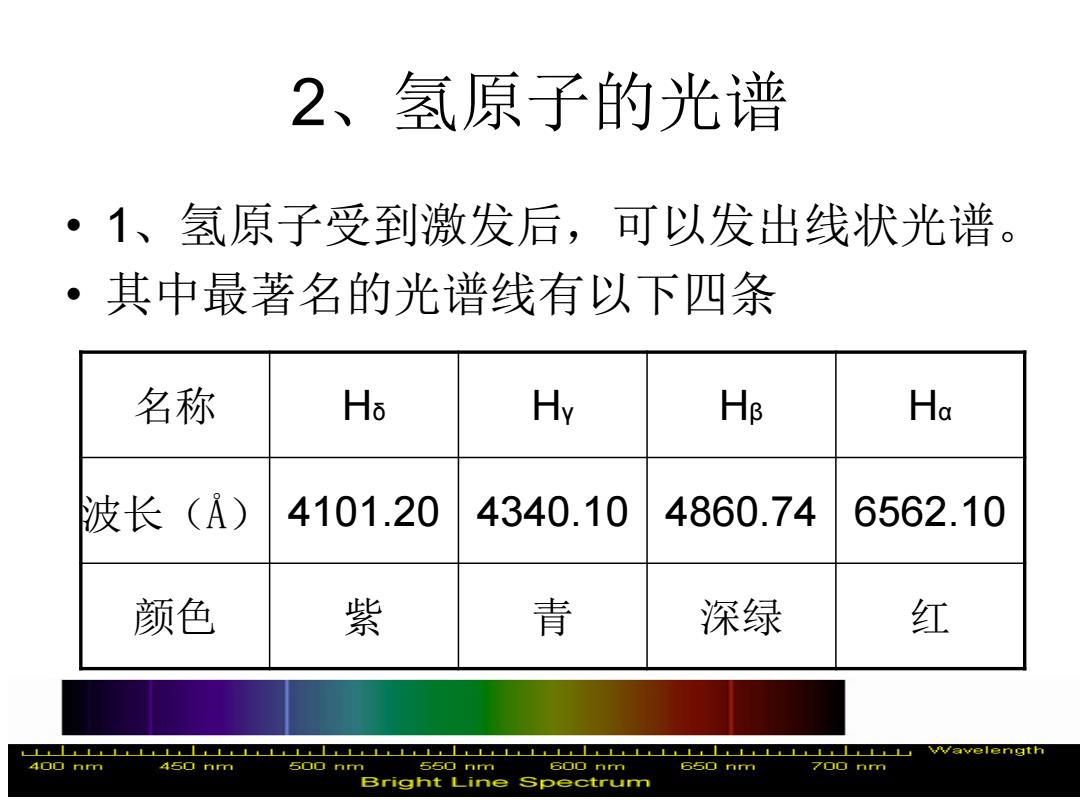
2、氢原子的光谱 ·1、氢原子受到激发后,可以发出线状光谱。 ·其中最著名的光谱线有以下四条 名称 Ho Hv Hs Ha 波长(A) 4101.20 4340.10 4860.74 6562.10 颜色 紫 青 深绿 红 LLLLLLLLLLLLL LLLLLLLLL 4o▣nm 45☐mm 500 nm 550 nm 600 nm 65▣mm 700mm Bright Line spectrum
2、氢原子的光谱 • 1、氢原子受到激发后,可以发出线状光谱。 • 其中最著名的光谱线有以下四条 名称 Hδ Hγ Hβ Hα 波长(Å) 4101.20 4340.10 4860.74 6562.10 颜色 紫 青 深绿 红

氢的Balmer线系 ·Balmer发现,对于已知的14条氢的光谱线, 可以用一个简单的公式表示其波长分布 (1885年) n 九=B n2-4 n=3,4,5,·Balmer公式 其中B=3645.6An→0,。=B=3645.6A 线系限波长 HH. H H 连续光谱区 Balmer线系
氢的Balmer线系 • Balmer发现,对于已知的14条氢的光谱线, 可以用一个简单的公式表示其波长分布 (1885年) 4 2 2 − = n n λ B Balmer公式 其中 B = 3645.6A n = 3,4,5, n B →∞ = = , 3645.6 A λ∞ 线系限波长 λ Hδ Hγ Hβ Hα 连续光谱区 Balmer线系

·Balmer公式也可以改写为如下形式 n2 几= n2-4 2刘打 1 :波数 Rydberg常数 几 B D=化分Rydberg?方程 R1=1.0967758×107m-1 Johannes Robert Rydberg 线系限 紫外一一 可见H, Ho H。 Sweden,1854-1919 巴耳末线系示意图
• Balmer公式也可以改写为如下形式 2 2 2 1 1 2 n n B − = λ ν λ 1 ~ = H 4 R B = H 2 2 1 1 [ ] 2 R n ν = − 波数 Rydberg常数 Rydberg方程 7 1 H R 1.0967758 10 m− = × ] 1 2 1 [ 4 2 2 B n = − 4 2 2 − = n n λ B Johannes Robert Rydberg Sweden ,1854-1919
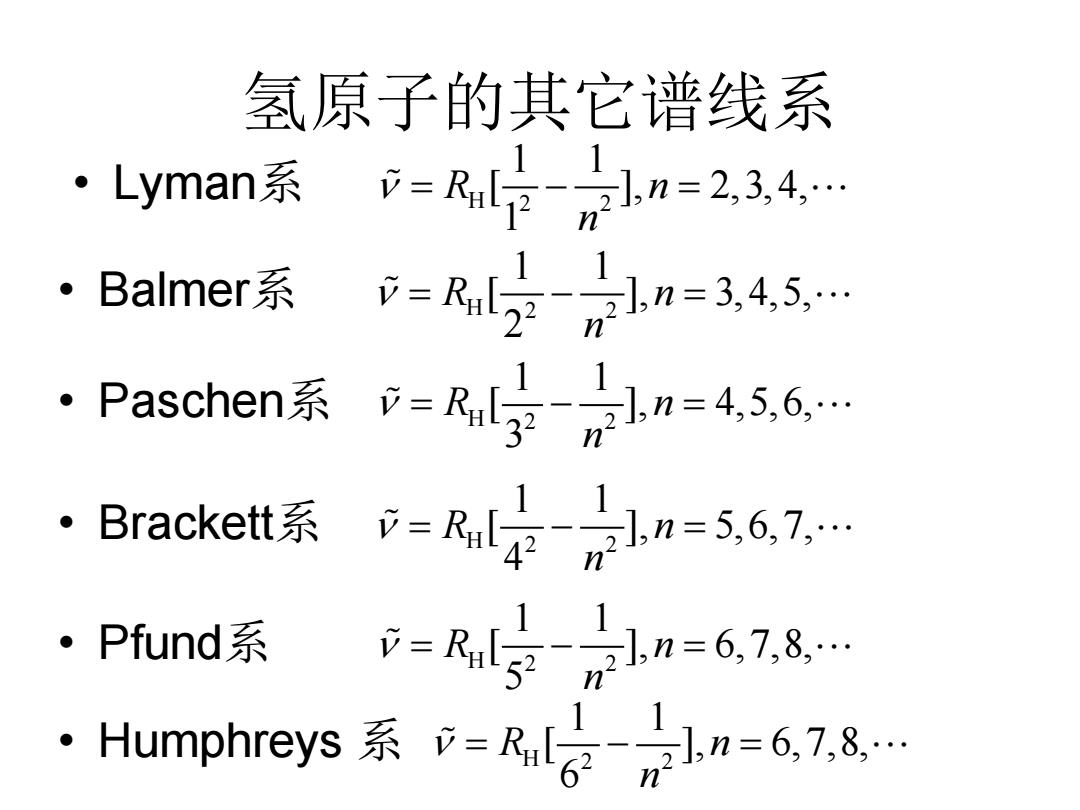
氢原子的其它谱线系 Lyman系-儿日u=234, ·Balmer系i=R2n=34,5 ·Paschen系=Rr写Ln=5.6 ·Bracket系=Rn-6,7, ·Pfund系 =R5n=678 .Humphreys系p=R哈ln=67,8
氢原子的其它谱线系 • Lyman系 H 2 2 1 1 [ ], 2,3, 4, 1 R n n ν =−= • Balmer系 H 2 2 1 1 [ ], 3, 4,5, 2 R n n ν = −= • Paschen系 H 2 2 1 1 [ ], 4,5,6, 3 R n n ν = −= • Brackett系 H 2 2 1 1 [ ], 5,6,7, 4 R n n ν = −= • Pfund系 H 2 2 1 1 [ ], 6,7,8, 5 R n n ν = −= • Humphreys 系 H 2 2 1 1 [ ], 6,7,8, 6 R n n ν = −=