
按质子理论,Na2HPO4是: A.中性物质 B.酸性物质 C.碱性物质 D.两性物质 E.酸碱惰性物质 答:D 按质子理论,下列物质中何者具有两性? A.HCO3 B.C032- C.HP042- D.NO3 E.HS 答:A、C、E 山东理王大深 Analytical Chemistry 11
Analytical Chemistry 11 按质子理论,Na2HPO4是: A.中性物质 B. 酸性物质 C. 碱性物质 D. 两性物质 E. 酸碱惰性物质 按质子理论,下列物质中何者具有两性? A. HCO3 - B. CO3 2- C. HPO4 2- D. NO3 - E. HS- 答:D 答:A、 C、 E

二、酸碱反应类型与平衡常数 1、溶剂分子之间的质子转移反应一质子自递反应 H,O+H,O=H,O+OH H,O=H*+OH K。=H,O*][OH]=H][OH]=1x10-14 SH+SH=SH,+S7 K。=[SH2][S] K一溶剂分子的质子自递常数 山东理子大军 Analytical Chemistry 12
Analytical Chemistry 12 + − H2 O+ H2 O = H3 O + OH 1、溶剂分子之间的质子转移反应—质子自递反应 [SH ][S ] SH SH SH S 2 2 + − + − = + = + Ks K—溶剂分子的质子自递常数 1 4 [H3 O ][OH ] [H ][OH ] 1 10 + − + − − Kw = = = + − H2 O = H + OH 二、酸碱反应类型与平衡常数
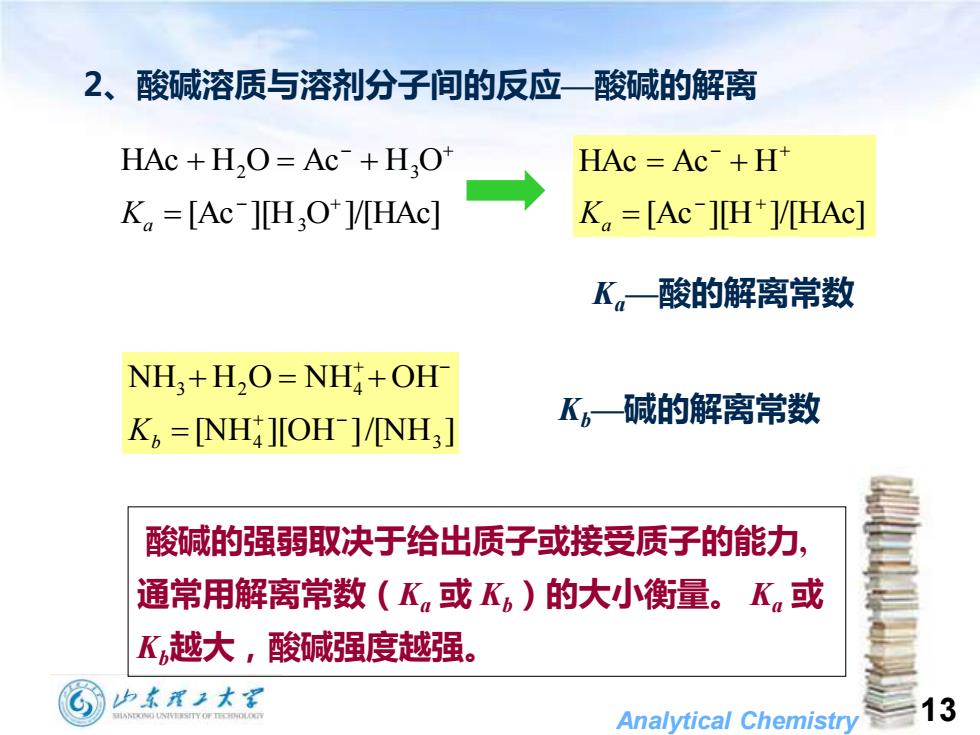
2、酸碱溶质与溶剂分子间的反应一酸碱的解离 HAc +H,O=Ac+H.O* HAc Ac+H K =[Ac-]HO*V/HAc] K =[Ac-][H*1/HAc] K。一酸的解离常数 NH,+H,O=NH+OH K=NH J[OH NH] K。一碱的解离常数 酸碱的强弱取决于给出质子或接受质子的能力, 通常用解离常数(K或K)的大小衡量。K,或 K越大,酸碱强度越强。 少末理子大军 Analytical Chemistry 13
Analytical Chemistry 13 2、酸碱溶质与溶剂分子间的反应—酸碱的解离 [Ac ][H O ]/[HAc] HAc H O Ac H O 3 2 3 − + − + = + = + Ka [Ac ][H ]/[HAc] HAc Ac H − + − + = = + Ka Ka—酸的解离常数 Kb—碱的解离常数 [NH ][OH ]/[NH ] NH H O NH OH 4 3 3 2 4 + − + − = + = + Kb 酸碱的强弱取决于给出质子或接受质子的能力, 通常用解离常数(Ka 或 Kb)的大小衡量。 Ka 或 Kb越大,酸碱强度越强
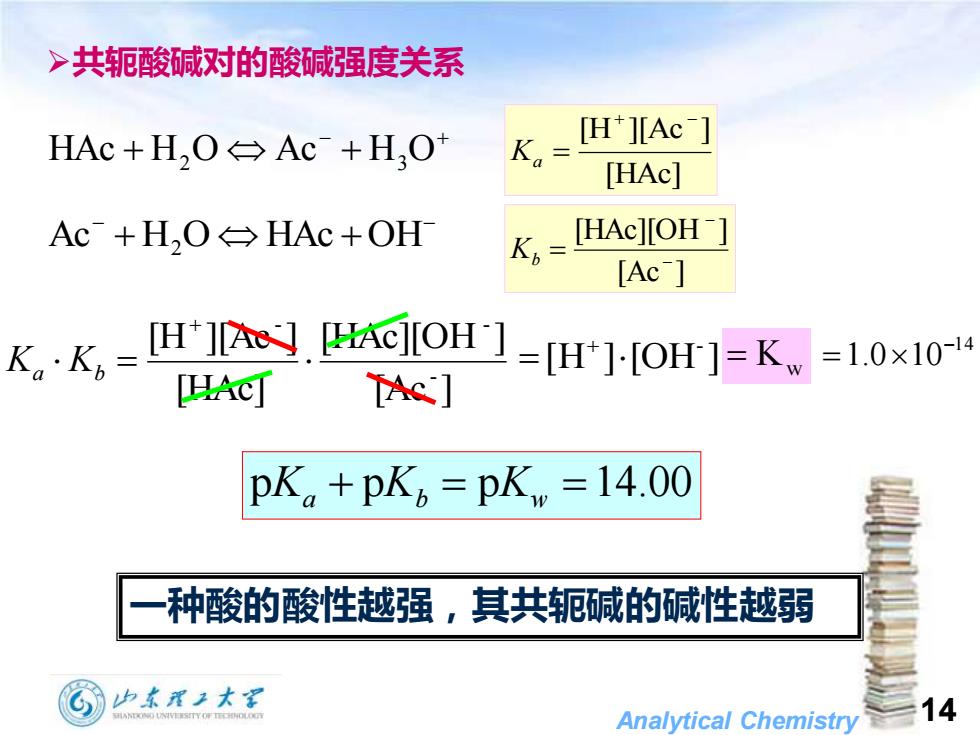
>共轭酸碱对的酸碱强度关系 HAc+H,O→Ac+H,O Ka= [H*][Ac] [HAc] Ac+H,O→HAc+OH K=LHAc]IOH [Ac kK。-H.dOH=门-HoH1=K=10x10 HA网 TAc] pK+pkpK =14.00 种酸的酸性越强,其共轭碱的碱性越弱 加东理2大深 Analytical Chemistry 14
Analytical Chemistry 14 ➢共轭酸碱对的酸碱强度关系 − + HAc + H2 O Ac + H3 O [HAc] [H ][Ac ] + − Ka = − − Ac + H2 O HAc +OH [Ac ] [HAc][OH ] − − Kb = [Ac ] [HAc][OH ] [HAc] [H ][Ac ] - - - = + Ka Kb [H ] [OH ] - = + = Kw 14 1.0 10− = pKa + pKb = pKw =14.00 一种酸的酸性越强,其共轭碱的碱性越弱
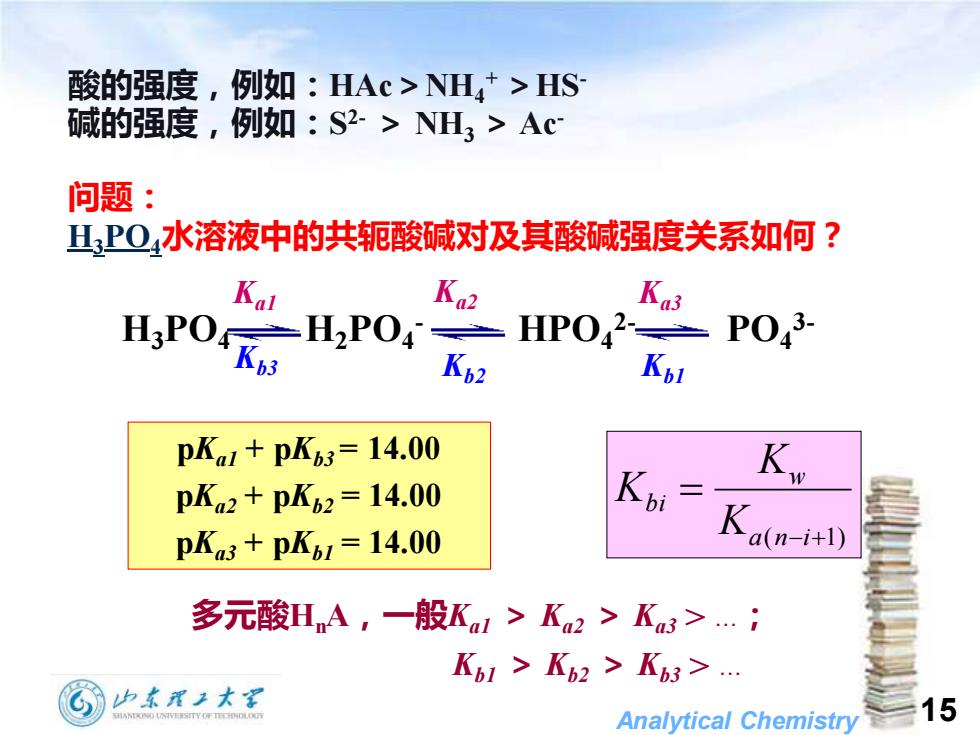
酸的强度,例如:HAc>NH4+>HS 碱的强度,例如:S2->NH3>Ac 问题: 山,P04水溶液中的共轭酸碱对及其酸碱强度关系如何? Kal Ka2 Ka3 H:PO H2P04 HP042 P043- Kpl pKa1+pK63=14.00 Kie pKa2+pK62=14.00 pKa3+pK61=14.00 Ka(n) 多元酸HnA,一般Ka1>K2>Ka3>.氵 K61>Kb2>K63> 山东理工大军 Analytical Chemistry 15
Analytical Chemistry 15 酸的强度,例如:HAc>NH4 + >HS- 碱的强度,例如:S 2- > NH3 > Ac- 问题: H3PO4水溶液中的共轭酸碱对及其酸碱强度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb2 Kb1 Kb3 Ka1 Ka2 Ka3 pKa1 + pKb3= 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 ( − +1) = a n i w bi K K K 多元酸HnA,一般Ka1 > Ka2 > Ka3 > .; Kb1 > Kb2 > Kb3 >