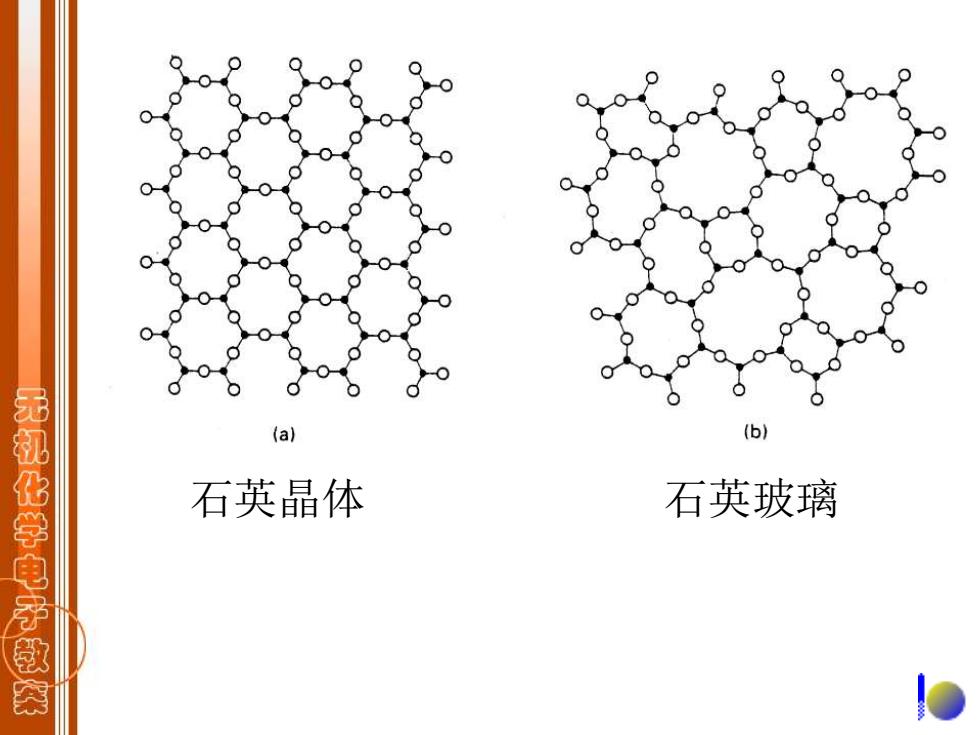
(a】 无机化学电子教茶 石英晶体 石英玻璃
石英晶体 石英玻璃
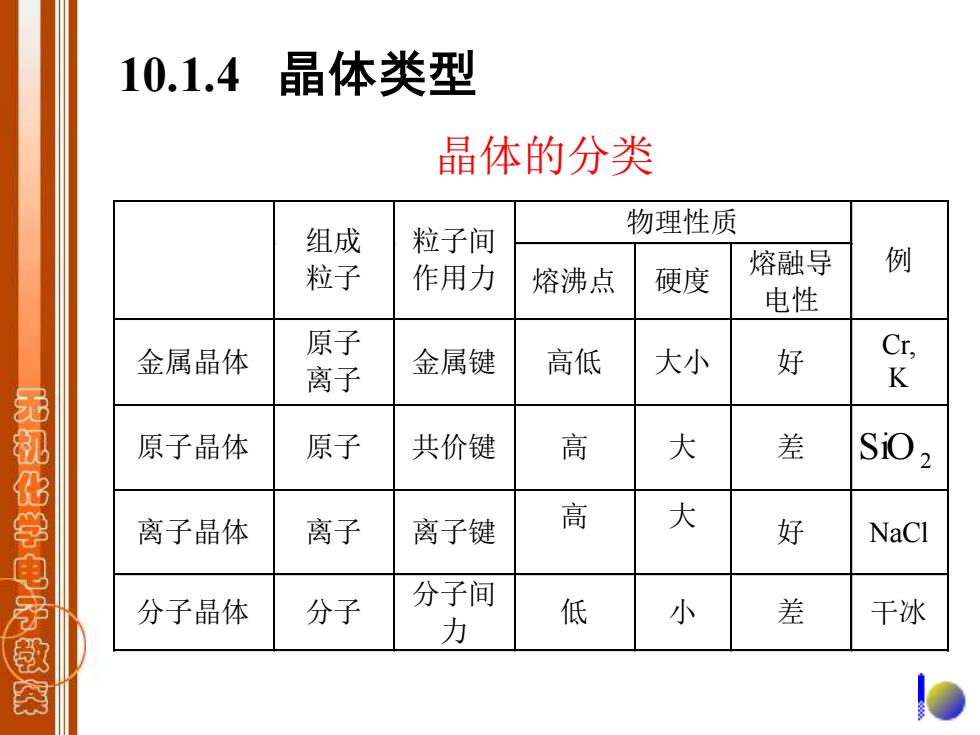
10.1.4晶体类型 晶体的分类 组成 粒子间 物理性质 粒子 作用力 熔融导 例 熔沸点 硬度 电性 金属晶体 原子 离子 金属键 高低 大小 好 , K 无机化学电子款 原子晶体 原子 共价键 高 大 差 SiO2 离子晶体 离子 离子键 高 大 好 NaCl 分子晶体 分子 分子间 力 低 小 差 干冰
晶体的分类 物理性质 组成 粒子 粒子间 作用力 熔沸点 硬度 熔融导 电性 例 金属晶体 原子 离子 金属键 高低 大小 好 Cr, K 原子晶体 原子 共价键 高 大 差 离子晶体 离子 离子键 高 大 好 NaCl 分子晶体 分子 分子间 力 低 小 差 干冰 SiO2 10.1.4 晶体类型

§10.3 高子晶体 10.3.1离子晶体的结构(自学) 10.3.2晶格能 3>10.3.3 离子极化 返回
10.3.1 离子晶体的结构(自学) §10.3 离子晶体 10.3.3 离子极化 10.3.2 晶格能

10.3.2 晶格能 定义:在标准状态下,按下列化学反 应计量式使离子晶体变为气体正离子和气 态负离子时所吸收的能量称为晶格能,用 U表示。 无机化学电子款 MXi(s)-aMb+(g)+bxa(g) 例如:NaC(s)△RNa'(g+CI(g △rH品-786kJ·mol U=786kJ.mol-1
定义:在标准状态下,按下列化学反 应计量式使离子晶体变为气体正离子和气 态负离子时所吸收的能量称为晶格能,用 U 表示。 -1 U = 786kJmol 10.3.2 晶格能 MaXb (s) aMb+(g) + bXa- (g) -1 = 786kJmol △ rHm NaCl(s) Na (g) + Cl (g) + - 例如: △ rHm

l.Born-Haber循环 Br:(D △H品 K(S)+ KBr(s) 气化热△H品 华 A H Br2(g) 焓 2 1 △Ha4 无机化学电子教茶 Br(g) △以品 Br (g) 电子亲和能 + K(g) △H品2 电离能 K"(g)
1.Born-Haber循环 Br (g) − K(s) Br (l) 2 1 2 K(g) Br (g) Br (g) −U 2 1 2 K (g) + + + KBr(s) 升 华 焓 电离能 气化热 键能 2 1 电子亲和能 △ fHm △ rHm,1 △ rHm,2 △ rHm,3 △ rHm,4 △ rHm,5 △ rHm,6