
§7-2 热力学第一定律 7.2.1热力学第一定律 一般情况下,系统状态变化时,功和热量的交换常常是 同时进行。一系统从状态(其对应的内能为E),变化 到状态Ⅱ(对应的内能为E2),从外界吸收的热量为Q, 而整个过程中,系统对外做功为A,则由能量守恒律,得 Q=(E2-E)+A dQ=dE+dA 即,系统吸收的热量,一部分转化成系统的内能;另一 部分转化为系统对外所做的功。这就是热力学第一定律。 热力学第一定律是包括热现象在内的能量转化与守恒定律。 首页上页下页退出
首 页 上 页 下 页 退 出 11 §7-2 热力学第一定律 一般情况下,系统状态变化时,功和热量的交换常常是 同时进行。一系统从状态I(其对应的内能为E1),变化 到状态II(对应的内能为E2),从外界吸收的热量为Q, 而整个过程中,系统对外做功为A,则由能量守恒律,得 Q=(E2 -E1)+A 或 dQ=dE+dA 即,系统吸收的热量,一部分转化成系统的内能;另一 部分转化为系统对外所做的功。这就是热力学第一定律。 7.2.1 热力学第一定律 热力学第一定律是包括热现象在内的能量转化与守恒定律

符号规定 吸热为正, 放热为负 系统对外做功为正 外界对系统做功为负 各物理量的单位统一用国际单位制。 12 首页上页下页退出
首 页 上 页 下 页 退 出 12 外界对系统做功为负. 系统对外做功为正, A 各物理量的单位统一用国际单位制。 符号规定 放热为负. 吸热为正, Q

7.2,2热一律在理想气体等值过程中的应用 1、等体过程 卫 特征d=0dA=0 4=0 热一律为Q=AE 等体线 在等体过程中,外界传给气体的 热量全部用来增加气体的内能,系 V 统对外不做功。 13 首页上页下页退出
首 页 上 页 下 页 退 出 13 7.2.2 热一律在理想气体等值过程中的应用 1、等体过程 0 0 V 特征 dV dA = = 热一律为 QV = E 在等体过程中,外界传给气体的 热量全部用来增加气体的内能,系 统对外不做功
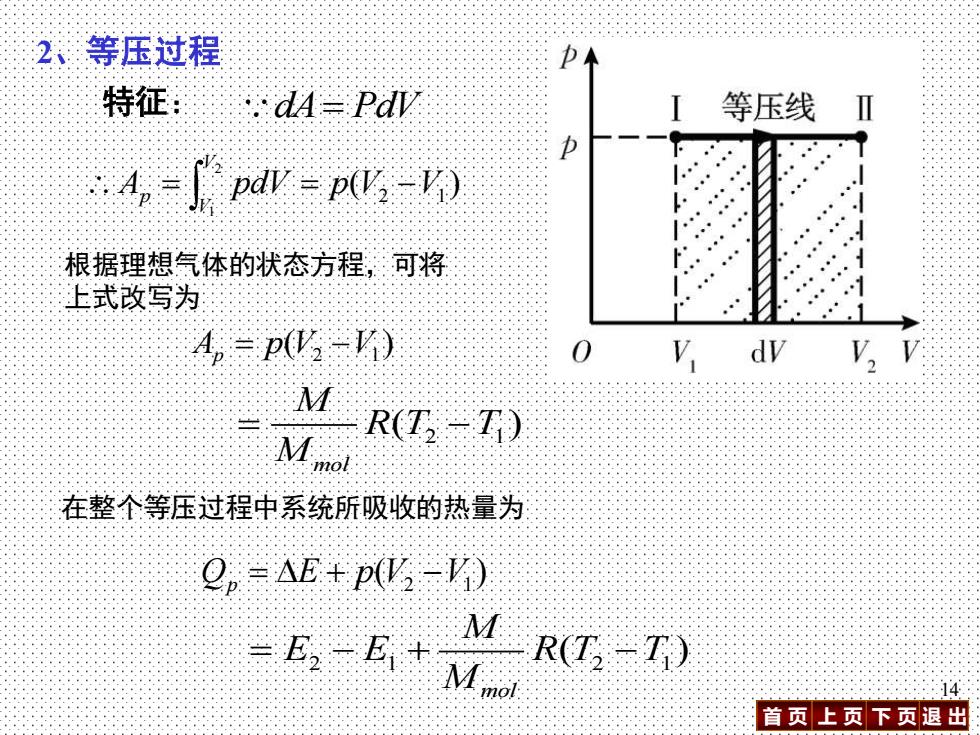
2、等压过程 特征:.dA=PdD 等压线Ⅱ D 4n=W=pW,-) 根据理想气体的状态方程,:可将 上式改写为 A,=p(V3-K) 0 V,dv v,v 4 Mmol R(T-T) 在整个等压过程中系统所吸收的热量为 Q,=AE+p化=) =E。-E+Mo M R(T-T) 14 首页上页下页退出
首 页 上 页 下 页 退 出 14 2 1 2 1 ( ) mol M E E R T T M = − + − 2、等压过程 dA= PdV = = − 2 1 ( ) 2 1 V V Ap pdV p V V 2 1 ( ) Q E p V V p = + − 在整个等压过程中系统所吸收的热量为 特征: 根据理想气体的状态方程,可将 上式改写为 2 1 ( ) A p V V p = − 2 1 ( ) mol M R T T M = −
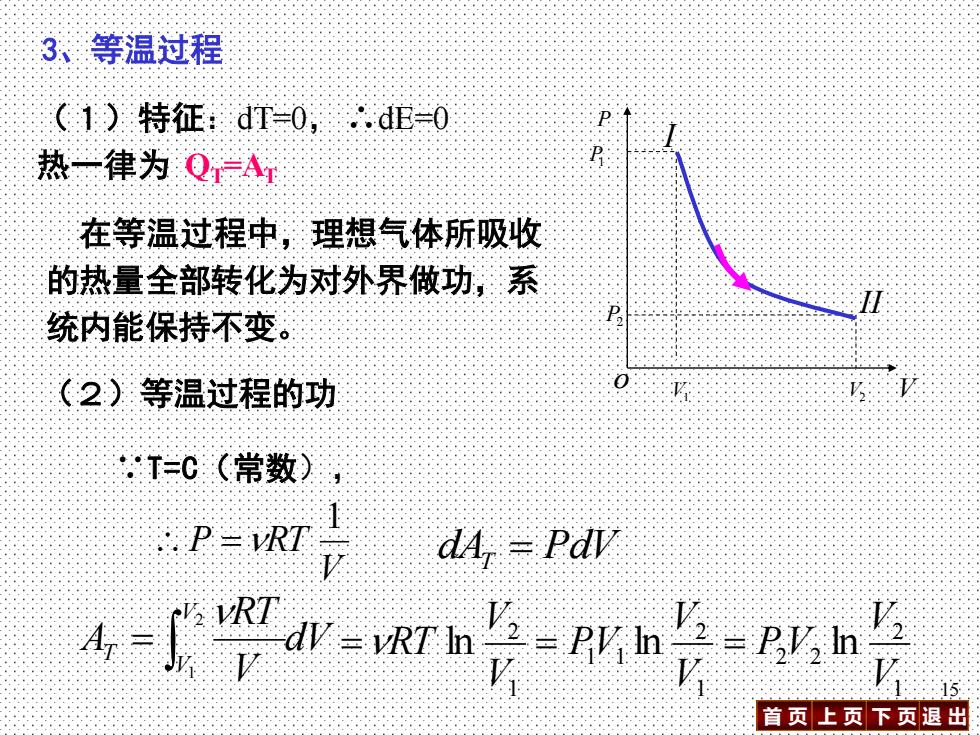
3、等温过程 (1)特征:dT=0,.dE=0 热一律为QA 在等温过程中,理想气体所吸收 的热量全部转化为对外界做功,系 统内能保持不变。 (2)等温过程的功 =0(常数) PR清 dA,PdV %吃h明 15 首页上页下页退出
首 页 上 页 下 页 退 出 15 3、等温过程 (1)特征:dT=0,∴dE=0 热一律为 QT=AT 在等温过程中,理想气体所吸收 的热量全部转化为对外界做功,系 统内能保持不变。 P V o P1 I V1 V2 P2 II (2)等温过程的功 ∵T=C(常数), V P RT 1 = dAT = PdV dV V RT A V V T = 2 1 1 2 ln V V =RT 1 2 2 2 1 2 1 1 ln ln V V PV V V = PV =