
1)写出电极反应和电池反应 2)计算银氯化银电极的标准电极电势E0(CI1 AgCI/Ag): 3)求0.462 mol-Kg的HCI的活度及HCI离子的平均活度系数y士: 解:1)+)AgCI(s)te→Ag(s)+C. ① -)0.5H2(100kPa)e→f... .① 电池AgCI(s+0.5H2(100kPa)=Ag(s)+HCIb=0.50 moI.kg)..① 2)E=E(CI/AgCI/Ag)=E(Ag'/Ag)+0.05916VIgK =0.7994V+0.05916V1g1.75×101° =07994V+0.05916V×(-9.757) =0.2222V. ②+① E=E°-0.059161ga(HCI) 得:0.276V=0.2222V-0.05916lga(HC) ② a(HC=0.1232.① a(HCI)=a(HCI)0.5=0.351........ .① y±=a±b±/b°)=0.351/0.462=0.760 ① 五(10分)已知水和异丁醇系统相图如下,在101.325kpa时,系统的共沸点 为89.7℃,三相平衡时的组成(质量百分数)如图所示: 1).填写下表:④+② 2)有350克水和150克异丁醇形成的系统在101.325KPa下由室温加热,问 当温度刚达到时共沸点时,系统处于相平衡时存在哪些相,其质量各为多少 克? 答:存在此1+, ①系统点组成:异丁醇30%
1)写出电极反应和电池反应; 2)计算银-氯化银电极的标准电极电势 E (CI- /AgCI/Ag); 3)求 0.462mol·Kg-1 的 HCI 的活度及 HCI 离子的平均活度系数 ; 解:1)+)AgCl(s)+e→Ag(s)+Cl -………………………………① -)0.5H2(100kPa)-e→H+……………………………….① 电池 AgCI(s)+0.5H2(100kPa)=Ag(s)+HCI(b=0.50mol.kg1 )…….① 2)E E Cl AgCl Ag E Ag Ag 05916V1gKsp = ( / / ) = ( / ) +0. − + =0.7994V+0.05916V1g1.75 10 10 =07994V+0.05916V (−9.757) =0.2222V……..................................................................②+① 3)EMF = E (Cl / AgCI / Ag) = 0.2222V − …………………………….① E=E −0.05916Iga(HCl) 得: 0.276V=0.2222V-0.05916Ig (HCl)……………………….② a(HCl)=0.1232……………………………………….① a (HCl)=a(HCl) 0.5=0.351………………………………….① =a /( / ) = 0.351/0.462 = 0.760 b b ……………………① 五(10 分)已知水和异丁醇系统相图如下,在 101.325kpa 时,系统的共沸点 为 89.7℃,三相平衡时的组成(质量百分数)如图所示: 1).填写下表:④+② 2)有 350 克水和 150 克异丁醇形成的系统在 101.325KPa 下由室温加热,问 当温度刚达到时共沸点时,系统处于相平衡时存在哪些相,其质量各为多少 克? 答:存在此 1 2 l +l ①系统点组成:异丁醇 30%
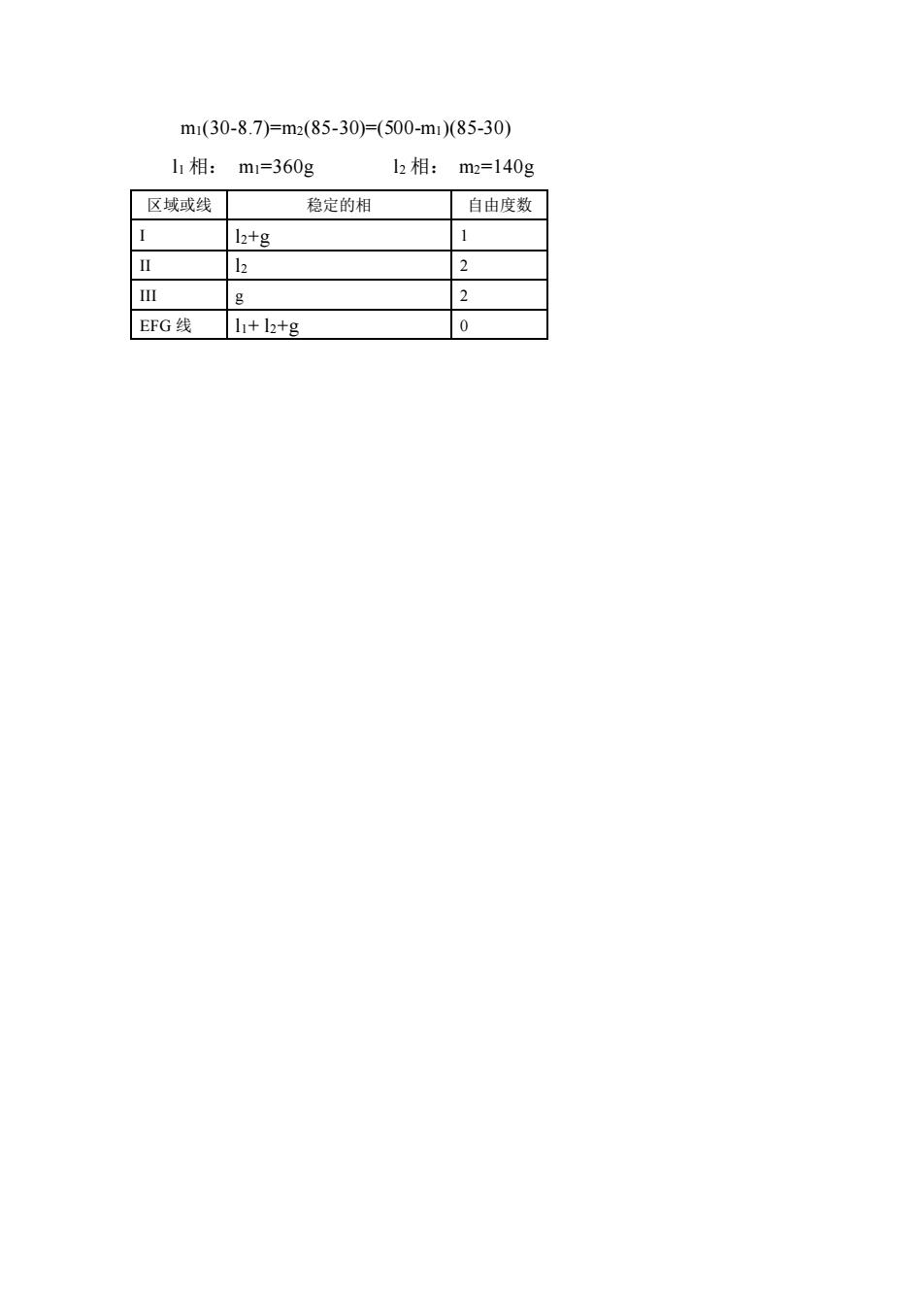
m1(30-8.7)=m2(85-30)=(500-m1)(85-30) 11相:m1=360g 2相:m2-140g 区域或线 稳定的相 自由度数 12+g 1 2 g 2 EFG线l+l2+g 0
m1(30-8.7)=m2(85-30)=(500-m1)(85-30) l1 相: m1=360g l2 相: m2=140g 区域或线 稳定的相 自由度数 I l2+g 1 II l2 2 III g 2 EFG 线 l1+ l2+g 0

兰州交通大学试卷 物理化学(D卷)参考答案 一、(12分每题2分)选择题 1.D 2.A3.D 4.C5.C6.A 二、(20分)填空题 1.1:1 2.旷(a,)=*(a±,) 3.55.89kJ·mol 4.3.73 5.0.880.545 6.>>>= 7.[(AgCI)nAg*-(n-x)NO;I .xNO; Na:PO>KSO>NaCl 三、(16分) 解:1.E。=30626×8.314=254.6 kJ.mol A-2×10s k2x10exp-3062S=10x10S g8 2.△,H.=E。-RT=254.6-8.314×1000x103=246.2kJ-mol A=阳” 89hS24太mr 四、(16分) 扇1.A0as0)-色-2610-26x10rsmm 1
一、(12 分每题 2 分)选择题 1.D 2.A 3.D 4.C 5.C 6.A 二、(20 分)填空题 1. 1:1 2. H+ (a±,2)=H + (a±,1) 3. 55.89kJ·mol-1 4. 3.73 5. 0.88 0.545 6. > > > = 7. + - x+ - m 3 3 [(AgCl) nAg (n-x)NO ] xNO Na3PO4>K2SO4>NaCl 三、(16 分) 解:1. 1 30626 8.314 254.6kJ mol E a − = = 10 1 A 2 10 S− = 10 3 1 30626 2 10 exp( ) 1.0 10 S 1000 k − − = − = 1 3 2 0.693 0.693 693S 1.0 10 t k − = = = 2. 3 1 r , 254.6 8.314 1000 10 246.2kJ mol H E RT m a − − = − = − = r , exp( ) B m k T S A e h R = r , ln m B Ah S R k Te = 10 34 1 1 23 2 10 6.626 10 8.314 ln 66.09J K mol 1.38 10 1000 2.72 − − − − = = − 四、(16 分) 解:1. 2 2 2 -1 2 4 2.6 10 (Na SO ) 2.6 10 S m mol 1 m k C − − = = =

(S0)=Na,S0)-2(Na)=2.6×102-2×5×10-3=1.60×102S-m2.mol (CaS0,)=(Ca*)+2(S0)=2×6×103+1.6×102=2.80×10-2S-m2.mol 2.kc0,=k张谣流-K:0,=7.0×102-2.6×102=4.4×102S·m .4.4×102 C(CaO.157m-15710ml-kg -o1” 1 =2.465×106(°=1mol·dm) 五、(20分) 解:1.负极Pb+S02=PbS04s+2e 正极 Hg2S04的+ 2e- +S02 电池反应①Pbg+Hg2SO4=PbS04周+2HgD 2.△,Gn=-2EF=-2×0.9647x96500=-186.19Jmol 4.=2F 67=2×96500×1.74x10=33.58-Km0 4,Hn=△,Gm+T△,Sm=(-186.19)+298.15×33.58×103=-176.18kmol Q.=T△S.=298.15×33.58=10.01kJ 3.可逆充电PbS0十 2Hgd)=Pbro)Hg:SO4(S) Q=2nF-ZWF M W-%_02x30x60x206-0384g ZF 2×96500 六、(16分) 解:1.2-2=2×00718-=1436Pa 106 2×0.0718×0.018 R7rp8314×298.15x10×10=1.043x10
4 2- + 2 3 2 2 -1 2 4 (SO ) (Na SO ) 2 (Na ) 2.6 10 2 5 10 1.60 10 S m mol m m m − − − = − = − = 4 2+ 2- 3 2 2 2 -1 4 (CaSO ) (Ca ) (SO ) 2 6 10 1.6 10 2.80 10 S m mol m m m − − − = + = + = 2. CaSO Na SO 4 2 4 k k k = − 浓溶液 2 2 2 -1 7.0 10 2.6 10 4.4 10 S m − − − = − = 4 2 CaSO -3 3 -1 2 4 4.4 10 1.57mol m 1.57 10 mol kg (CaSO ) 2.8 10 S m k C − − − = = = 2 2 3 1.0 1.57 10 6 2.465 10 1 CS K C − − = = = (Cθ=1mol·dm-3 ) 五、(20 分) 解:1. 负极 Pb + SO4 2- = PbSO4(s) + 2e- 正极 Hg2SO4 (S) + 2e- = 2Hg(l) + SO4 2- 电池反应① Pb(s) + Hg2SO4 (S) = PbSO4 (S) + 2Hg(l) 2. 1 2 2 0.9647 96500 186.19kJ mol r m G EF − = − = − = − 4 1 1 2 ( ) 2 96500 1.74 10 33.58J K mol r m P E S F T − − − = = = 3 1 ( 186.19) 298.15 33.58 10 176.18kJ mol r m r m r m H G T S − − = + = − + = − 298.15 33.58 10.01kJ Q T S R r m = = = 3.可逆充电 PbSO4 (S) + 2Hg(l) = Pb(s) + Hg2SO4 (S) ZWF Q ZnF M = = 0.2 30 60 206 0.384g 2 96500 QM W ZF = = = 六、(16 分) 解: 1. 6 2 2 0.0718 143.6kPa 10 P a r − = = = 3 6 3 2 2 0.0718 0.018 ln 1.043 10 8.314 298.15 10 10 P r M P RTr − − = = =