
过程和途径 系统从一种状态变到另一种状态称为经历了一个过 程(process) ■几种特殊的过程: ■如果系统的状态变化是在温度不变的条件下发生的, 则此过程叫做等温过程(isothermal process) 如果在压力不变或体积不变的条件下发生的,则叫 做等压过程(isobaric process)或等容过程(isochoric process)。 ■在体系和环境间没有热交换,则称为绝热过程 (adiabatic process)
过程和途径 ◼ 系统从一种状态变到另一种状态称为经历了一个过 程(process) ◼ 几种特殊的过程: ◼ 如果系统的状态变化是在温度不变的条件下发生的, 则此过程叫做等温过程(isothermal process)。 ◼ 如果在压力不变或体积不变的条件下发生的,则叫 做等压过程(isobaric process)或等容过程(isochoric process)。 ◼ 在体系和环境间没有热交换,则称为绝热过程 (adiabatic process)
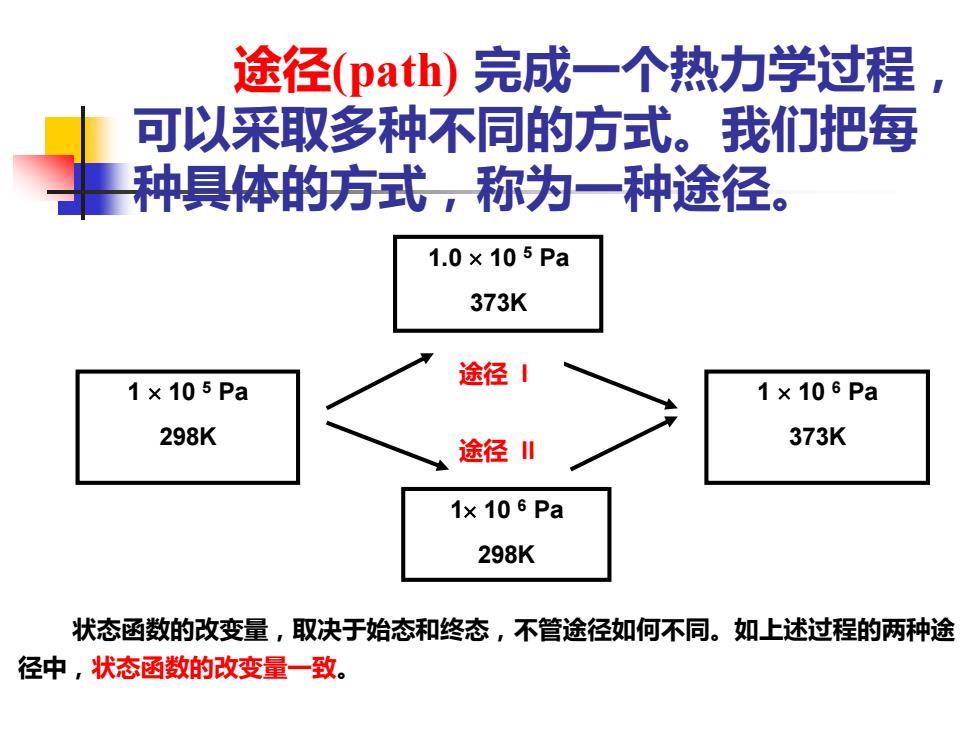
途径(path)完成一个热力学过程 可以采取多种不同的方式。我们把每 种具体的方式,称为一种途径。 1.0×105Pa 373K 途径1 1×105Pa 1×106Pa 298K 途径川 373K 1x 106 Pa 298K 状态函数的改变量,取决于始态和终态,不管途径如何不同。如上述过程的两种途 径中,状态函数的改变量一致
途径(path) 完成一个热力学过程, 可以采取多种不同的方式。我们把每 种具体的方式,称为一种途径。 途径 I 1.0 10 5 Pa 373K 途径 II 1 10 6 Pa 298K 状态函数的改变量,取决于始态和终态,不管途径如何不同。如上述过程的两种途 径中,状态函数的改变量一致。 1 10 6 Pa 373K 1 10 5 Pa 298K

二热力学第一定律/ 功和热 在热力学中,把系统与环境间能量的交换或传递分为两种形 式。 由于温度不同而在系统和环境间交换或传递的能量称之为热 (heat),用符合Q表示。 ■并规定如系统从环境吸收热量,Q>0;系统向环境放出热 量,Q<0。 除热以外其余各种形式被传递的能量都叫做功(Wok), 用符合W俵示。 并规定系统对环境作功W<0;当环境对系统做功,>0。 在热力学中,常把功分为两种:由于体系体积变化而对环境 所做的功或环境对体系所做的功被称为体积功(volume work)i 或膨胀功(expansion work);非体积功
二 热力学第一定律 / 功和热 ◼ 在热力学中,把系统与环境间能量的交换或传递分为两种形 式。 ◼ 由于温度不同而在系统和环境间交换或传递的能量称之为热 (heat),用符合Q表示。 ◼ 并规定如系统从环境吸收热量,Q>0;系统向环境放出热 量,Q<0。 ◼ 除热以外其余各种形式被传递的能量都叫做功(work), 用符合W表示。 ◼ 并规定系统对环境作功W<0;当环境对系统做功,W>0。 在热力学中,常把功分为两种:由于体系体积变化而对环境 所做的功或环境对体系所做的功被称为体积功(volume work)或膨胀功(expansion work) ;非体积功

热力学能(thermodynamic energy) 系统内部能量的总和叫做系统的热力学能 (也称内能internal energy) ■用符合U表示。它包括系统内分子运动的平动能、 转动能、振动能、分子间的吸引与排斥,以及分子 内原子之间的相互作用(化学键),原子内核与电 子的作用等。 ★热力学能是状态函数:状态一定,U一定。 *热力学能属广度性质:能量都具有加和性。 *热力学能的绝对值无法确定
热力学能(thermodynamic energy) ◼ 系统内部能量的总和叫做系统的热力学能 (也称内能 internal energy) ◼ 用符合U表示。它包括系统内分子运动的平动能、 转动能、振动能、分子间的吸引与排斥,以及分子 内原子之间的相互作用(化学键),原子内核与电 子的作用等。 热力学能是状态函数:状态一定, U一定。 热力学能属广度性质:能量都具有加和性。 热力学能的绝对值无法确定

热力学第一定律(first law of thermodynamics) 就是能量守恒与转化定律。 △U=U2-U,=Q+W 例如,某一系统从环境吸收了300kJ的热量,对环境 做了200kJ的功,则系统的热力学能变化△U=(+300) +(一200)=100(kJ),即系统的热力学能增加了100kJ。 ■如果系统释放给环境热量为300kJ,环境对系统做了 200kJ的功,则系统的热力学能变化△U=(一300)+ (+200)=一100(kJ),即系统的热力学能减少了100k
热力学第一定律(first law of thermodynamics) ◼ 就是能量守恒与转化定律。 ◼ U =U2 -U1 =Q + W ◼ 例如,某一系统从环境吸收了300kJ的热量,对环境 做了200kJ的功,则系统的热力学能变化U =(+300) +(-200) =100(kJ),即系统的热力学能增加了100kJ。 ◼ 如果系统释放给环境热量为300 kJ,环境对系统做了 200 kJ的功,则系统的热力学能变化U =(-300)+ (+200)=-100(kJ),即系统的热力学能减少了100 kJ