
Part2 试验方案
Part2 试 验 方 案

试验方案 01 实验原理 04 有关参数和器材 02 实验步骤 05 化学试剂的安全使用 03 实验数据记录 06 其他注意事项
试 验 方 案 01 实验原理 02 实验步骤 03 实验数据记录 04 有关参数和器材 化学试剂的安全使用 05 其他注意事项 06

01 实验原理 制备明矾(碱法) 铝屑溶于浓氢氧化钾溶液,生成可溶性的四羟基合铝酸钾 K[AI (OH)4]KALO2? 配位化合物(简写) 加入一定量稀H2S04溶液,将其转化为A1(OH)3,再加过量的 H2S04,A1(OH)3溶解生成A12(S04)3,A2(S04)3能同碱金 属硫酸盐如《2S04在水溶液中结合成一类在水中溶解度较小的同晶的复 盐,此复盐称为明矾【KA1(S04)212H20],当冷却溶液时,明矾 则以大块晶体结晶出来。 2AI 2KOH 6H20 2K[AI (OH)4]3H21 2K[AI (OH)4]H2S04=2Al(OH)3+K2S04+2H20 2AI(OH)3+3H2SO4=AI2(S04)3+6H20 AI2(S04)3+K2S04+24H20=2KAI(S04)2.12H20 2022-3-11
2022-3-11 铝屑溶于浓氢氧化钾溶液,生成可溶性的四羟基合铝酸钾 K[Al(OH)4] 加入一定量稀 H2SO4溶液,将其转化为 Al(OH)3,再加过量的 H2SO4,Al(OH)3溶解生成 Al2(SO4)3,Al2(SO4)3能同碱金 属硫酸盐如 K2SO4在水溶液中结合成一类在水中溶解度较小的同晶的复 盐,此复盐称为明矾[KAl(SO4)2·12H2O],当冷却溶液时,明矾 则以大块晶体结晶出来。 01 实验原理——制备明矾(碱法) 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2↑ 2K[Al(OH)4] + H2SO4= 2Al(OH)3↓+K2SO4+ 2H2O 2Al(OH)3+ 3H2SO4= Al2(SO4)3+ 6 H2O Al2(SO4)3+ K2SO4+ 24H2O = 2KAl(SO4)2·12H2O KALO2? 配位化合物(简写)

01 实验原理 —组成测定 水 差减法 S042. 重量 Ba2++042:=BaS04U AI3+- 反滴定法 乙二胺四乙酸 EDTA 2022-311
2022-3-11 01 实验原理——组成测定 水 ———— 差减法 SO4²-———— 重量 Ba2+ + SO42- = BaSO4↓ Al3+-———— 反滴定法 乙二胺四乙酸 EDTA
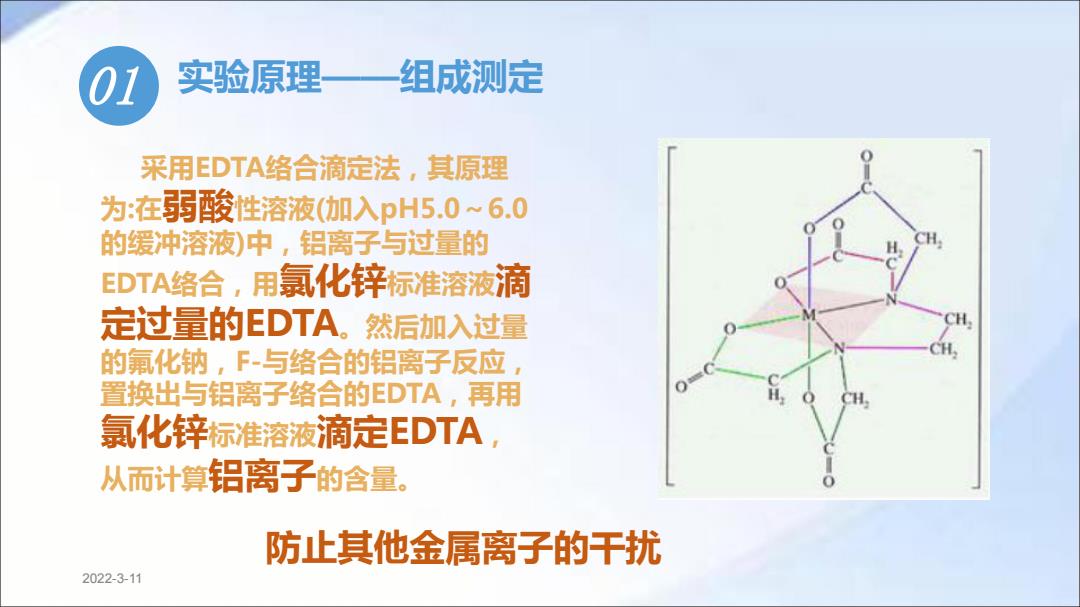
01 实验原理 组成测定 采用EDTA络合滴定法,其原理 为:在弱酸性溶液(加入pH5.0~6.0 的缓冲溶液)中,铝离子与过量的 EDTA络合,用氯化锌标准溶液滴 定过量的EDTA。然后加入过量 的氟化钠,F与络合的铝离子反应 置换出与铝离子络合的EDTA,再用 氯化锌标准溶液滴定EDTA, 从而计算铝离子的含量。 防止其他金属离子的干扰 2022-3-11
2022-3-11 01 实验原理——组成测定 采用EDTA络合滴定法,其原理 为:在弱酸性溶液(加入pH5.0~6.0 的缓冲溶液)中,铝离子与过量的 EDTA络合,用氯化锌标准溶液滴 定过量的EDTA。然后加入过量 的氟化钠,F-与络合的铝离子反应, 置换出与铝离子络合的EDTA,再用 氯化锌标准溶液滴定EDTA, 从而计算铝离子的含量。 防止其他金属离子的干扰