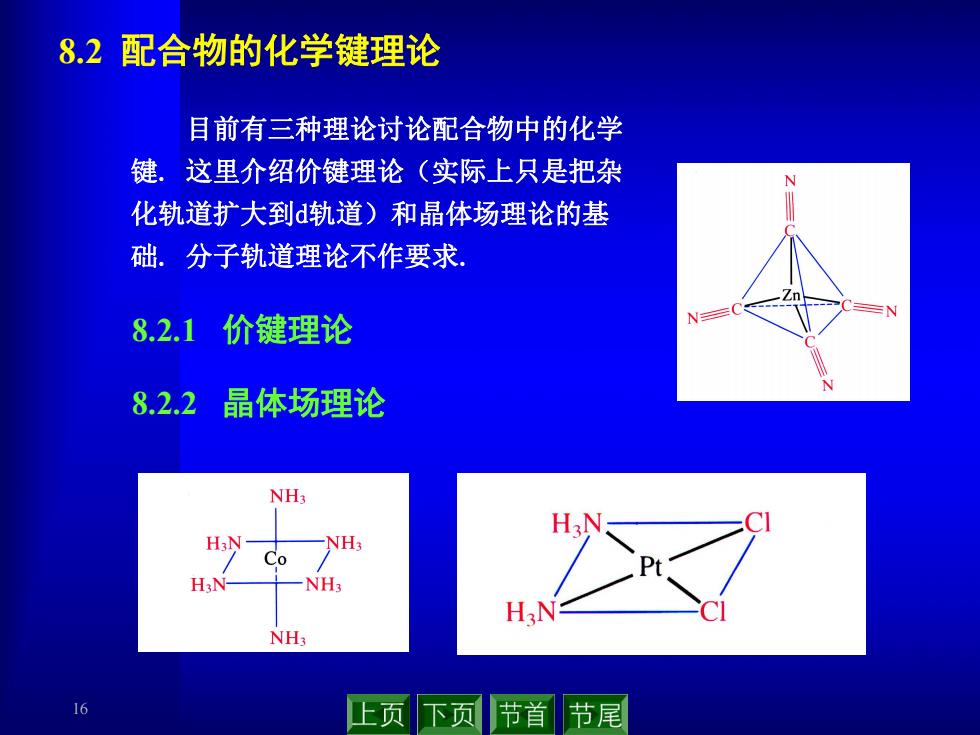
8.2配合物的化学键理论 目前有三种理论讨论配合物中的化学 键,这里介绍价键理论(实际上只是把杂 化轨道扩大到d轨道)和晶体场理论的基 础。分子轨道理论不作要求 8.2.1价键理论 8.2.2 晶体场理论 NH NH; Co H3N NH: H3N NH: 6 上页下页 节首节尾
16 8.2 配合物的化学键理论 8.2.1 价键理论 8.2.2 晶体场理论 目前有三种理论讨论配合物中的化学 键. 这里介绍价键理论(实际上只是把杂 化轨道扩大到d轨道)和晶体场理论的基 础. 分子轨道理论不作要求

配体NO2-在配合物中为什么有时称为 “硝基”,有时称为“亚硝酸根”? 止页下页 节首节尾
17 Question 1 配体NO2-在配合物中为什么有时称为 “硝基” ,有时称为“亚硝酸根”?
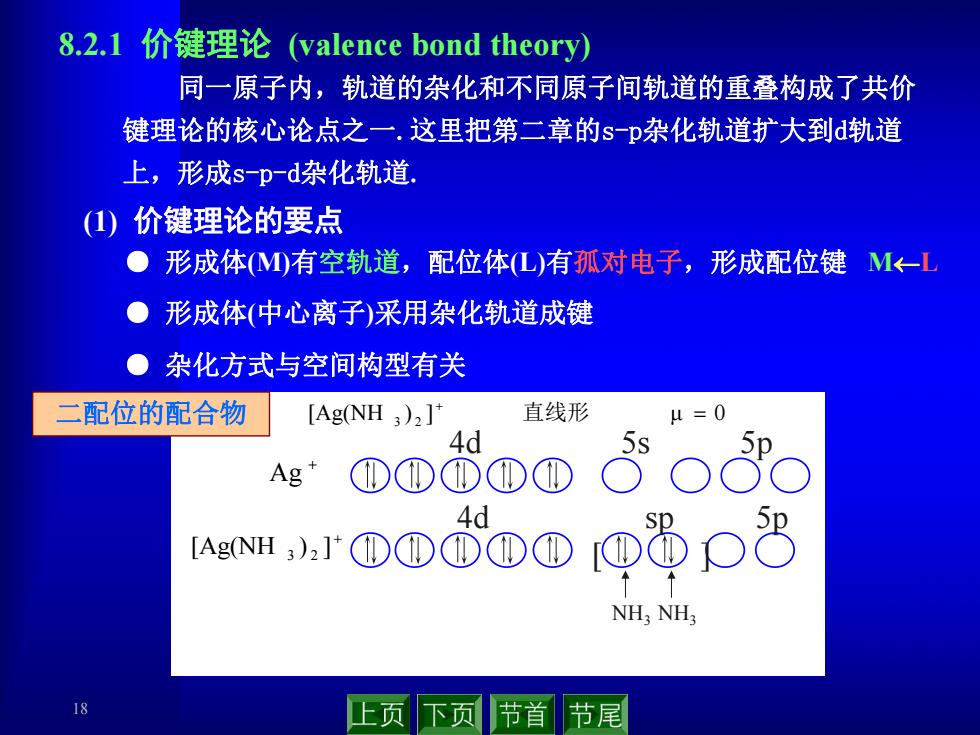
8.2.1价键理论(valence bond theory)) 同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价 键理论的核心论点之一.这里把第二章的sp杂化轨道扩大到轨道 上,形成s-pd杂化轨道, (1)价键理论的要点 ●形成体M)有空轨道,配位体(L)有孤对电子,形成配位键M←-L ● 形成体(中心离子)采用杂化轨道成键 ●杂化方式与空间构型有关 二配位的配合物 [Ag(NH 3)2]* 直线形 μ=0 4d Ag" ①①①①① AeNH.r①①O①@8p8 4d NH;NH 18 上页下页 节首节尾
18 ● 形成体(M)有空轨道,配位体(L)有孤对电子,形成配位键 ML ● 形成体(中心离子)采用杂化轨道成键 ● 杂化方式与空间构型有关 8.2.1 价键理论 (valence bond theory) 同一原子内,轨道的杂化和不同原子间轨道的重叠构成了共价 键理论的核心论点之一.这里把第二章的s-p杂化轨道扩大到d轨道 上,形成s-p-d杂化轨道. (1) 价键理论的要点 [Ag(NH ) ] μ 0 3 2 直线形 [Ag(NH ) ] 3 2 [ ] NH3 NH3 4d sp 5p Ag 4d 5s 5p 二配位的配合物
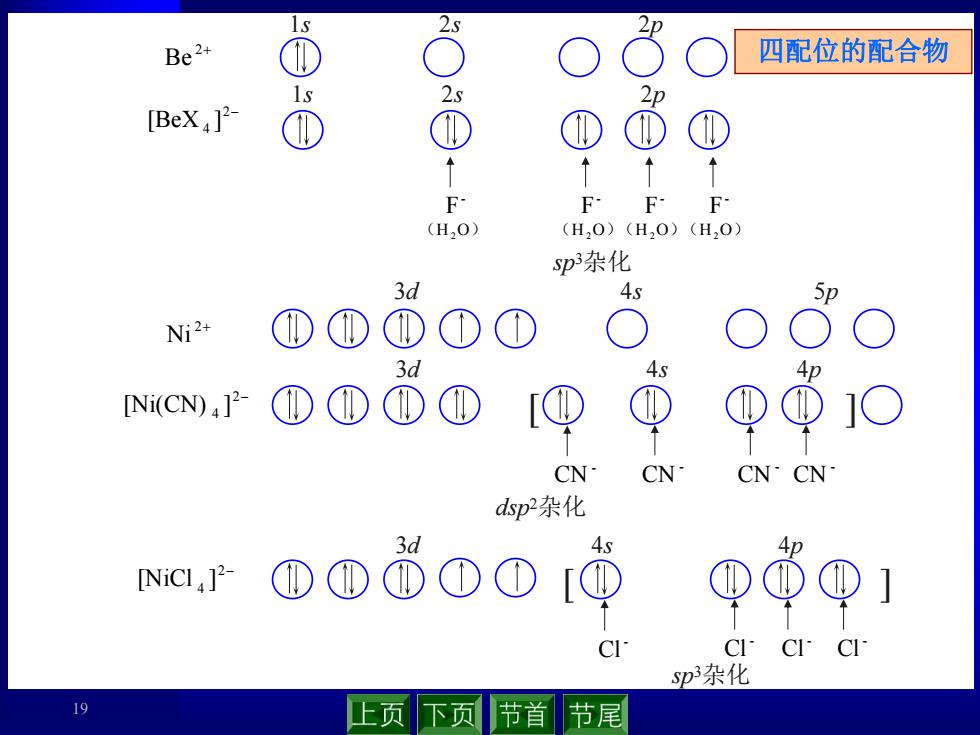
IS 2s Be2+ 四配位的配合物 IS 2s 2D [BeX]2 F F-F F (H,O) (H,0)(H20)(H20) sp杂化 3d 4s 5形 Ni2+ 3d 4s [Ni(CN)P2 ① ① ① ① CN CN CN·CN dsp2杂化 NiC,]2- ①①①①[ +.S ① ① CICI p杂化 19 上页 下页 节首 节尾
19 1s 2s 2p 2 Be 2 Ni 3d 4s 5p [ ] - CN - CN - CN - CN dsp 2杂化 2 4 [Ni(CN) ] 2 4 [BeX ] 1s 2s 2p - F - F - F - F (H2O) (H2O)(H2O)(H2O) sp 3杂化 [ ] - Cl - Cl - Cl - Cl sp 3杂化 2 4 [NiCl ] 3d 4s 4p 3d 4s 4p 四配位的配合物

六配位的配合物 [FeFc3-内轨配合物(inner orbital complexes))配位原子的电负 性很大,如卤素、氧等,不易给出孤电子对,使中心离子的结构不 发生变化,仅用外层的空轨道ns,p,nd进行杂化生成能量相同, 数目相等的杂化轨道与配体结合 [Fe(H2O)6]2+(four unpaired electrons) 3d 4s 4p 4d ①①①①① ① ①①① ①① sp'd2 hybridization Octahedral hybrid orbitals 20 上页 下页 节首节尾
20 [FeF6] 3- 内轨配合物 (inner orbital complexes) 配位原子的电负 性很大,如卤素、氧等, 不易给出孤电子对,使中心离子的结构不 发生变化,仅用外层的空轨道ns,np,nd进行杂化生成能量相同, 数目相等的杂化轨道与配体结合 六配位的配合物