
§3.2精溶液中的两个狂验定林 使用拉乌尔定律必须注意: 1.使用拉乌尔定律计算溶剂的蒸气压时,溶剂的摩尔质 量应采用其呈气态时的摩尔质量,而不考虑分子的缔 合等因素。 2.拉乌尔定律虽然最初是由非挥发性溶质的溶液总结出 来的,但后来人们发现,对于挥发性溶质的溶液也是 正确的,此时公式中p是溶液上方溶剂的蒸气分压, 因此,Raoult定律适用于任何稀薄溶液。由于溶剂中 一 旦加入非挥发性溶质,在溶液的单位表面上溶剂的 分子数就有所减小,使得在单位时间内从溶液表面逸 出的溶剂分子数也将相应减少,因此溶液的平衡蒸气 压也将降低。这就是Raoult定律的微观本质。 3.拉鸟尔定律一般只使用于非电解质溶液,电解质溶液 中的组分因存在电离现象,故拉乌尔定律不在使用。 上页 回主目录 返回 2024年9月5日
2024年9月5日 § 3. 2 稀溶液中的两个经验定律 使用拉乌尔定律必须注意: 1. 使用拉乌尔定律计算溶剂的蒸气压时,溶剂的摩尔质 量应采用其呈气态时的摩尔质量,而不考虑分子的缔 合等因素。 2. 拉乌尔定律虽然最初是由非挥发性溶质的溶液总结出 来的,但后来人们发现,对于挥发性溶质的溶液也是 正确的,此时公式中pA是溶液上方溶剂的蒸气分压, 因此,Raoult定律适用于任何稀薄溶液。由于溶剂中 一旦加入非挥发性溶质,在溶液的单位表面上溶剂的 分子数就有所减小,使得在单位时间内从溶液表面逸 出的溶剂分子数也将相应减少,因此溶液的平衡蒸气 压也将降低。这就是Raoult定律的微观本质。 3. 拉乌尔定律一般只使用于非电解质溶液,电解质溶液 中的组分因存在电离现象,故拉乌尔定律不在使用

§3,2精客浪中的两个發验定林 理想溶液:若溶液中的任一组分在全部浓度范围内都 严格服从Raoult定律,即 PA=PA XA PB-PB XB 则称为理想溶液。 严格服从公式的溶液系统是不存在的,但在有些情况下, 象异构体混合物、同位素混合物等可看作理想溶液。 图3-2-1为典型理想中由Raoult定律所得到的蒸气压与 组成的直线关系。 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 § 3. 2 稀溶液中的两个经验定律 理想溶液:若溶液中的任一组分在全部浓度范围内都 严格服从Raoult定律,即 则称为理想溶液。 严格服从公式的溶液系统是不存在的,但在有些情况下, 象异构体混合物、同位素混合物等可看作理想溶液。 图3-2-1为典型理想中由Raoult定律所得到的蒸气压与 组成的直线关系。 A p = A A p x B p = B B p x
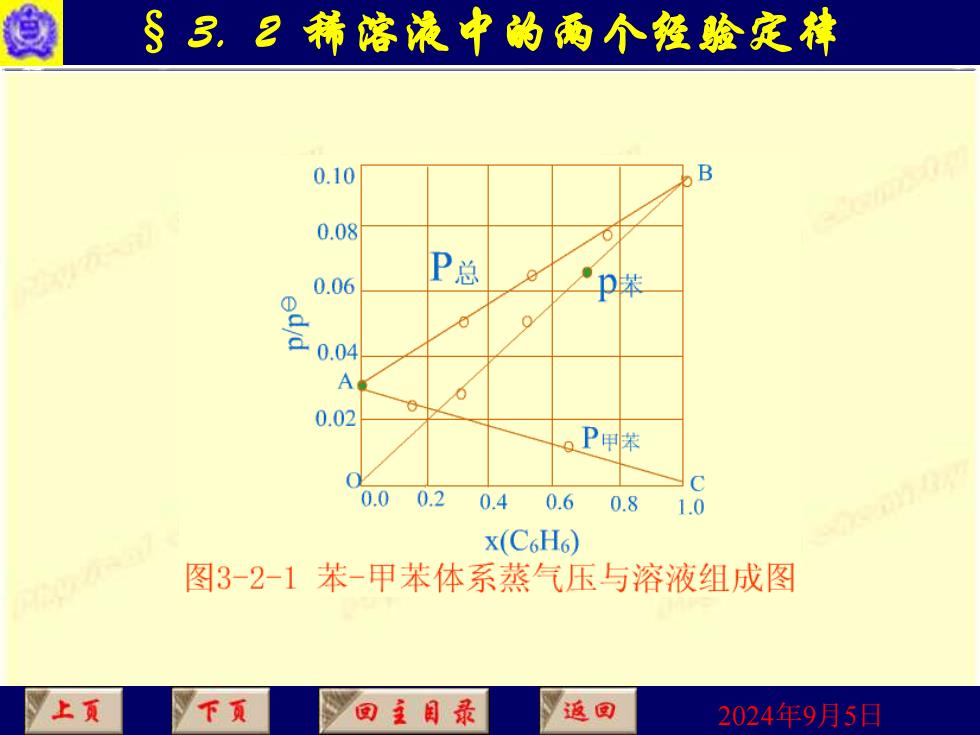
§3,2精溶液中的两个發验定林 0.10 B 0.08 ● 0.06 P总 p苯 ① 。 a0. A 0 0.02 。P甲苯 0.0 0.2 0.4 0.6 0.8 1.0 x(C6H6) 图3-2-1苯-甲苯体系蒸气压与溶液组成图 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 § 3. 2 稀溶液中的两个经验定律

§3,2精陪浓中的两个鞭验定林 有些体系对拉鸟尔定律呈正或负偏差 PA 正偏差 负偏差 XA 1 上页 下页 回主目录 返回 2024年9月5日
2024年9月5日 有些体系对拉乌尔定律呈正或负偏差 § 3. 2 稀溶液中的两个经验定律
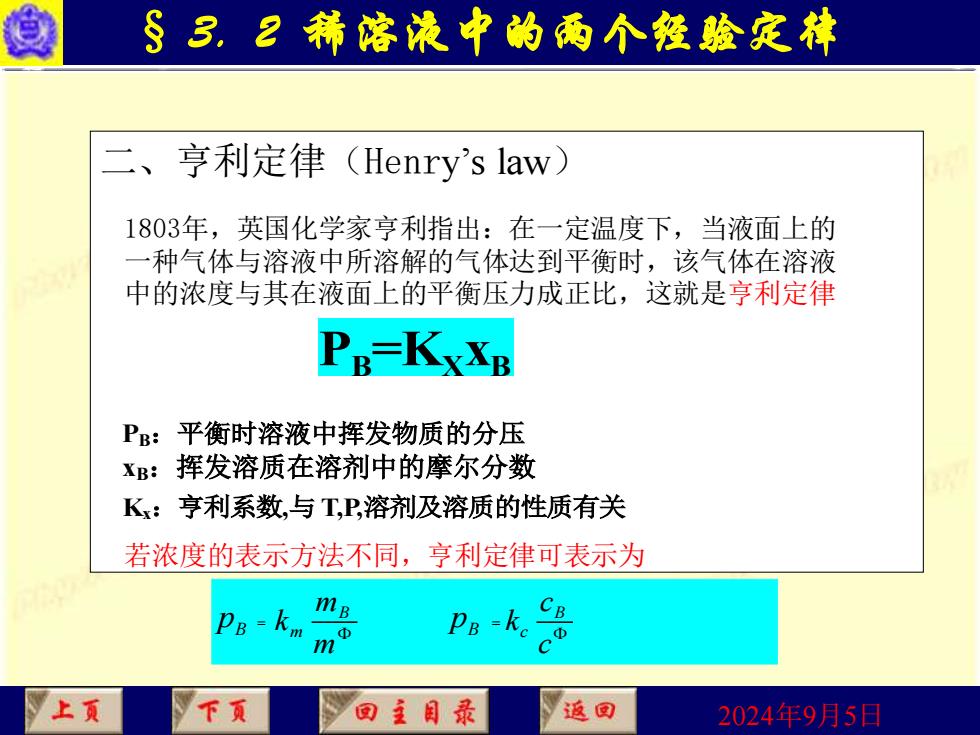
§3.2稀溶液中的两个發验定林 二、亨利定律(Henry'slaw) 1803年,英国化学家亨利指出:在一定温度下,当液面上的 一种气体与溶液中所溶解的气体达到平衡时,该气体在溶液 中的浓度与其在液面上的平衡压力成正比,这就是亨利定律 PE-KxXB P:平衡时溶液中挥发物质的分压 XB: 挥发溶质在溶剂中的摩尔分数 Kx:亨利系数,与T,P,溶剂及溶质的性质有关 若浓度的表示方法不同,亨利定律可表示为 PB-km mB Pa-ke cu 上页 回主目录 返回 2024年9月5日
2024年9月5日 § 3. 2 稀溶液中的两个经验定律 二、亨利定律(Henry’s law) 1803年,英国化学家亨利指出:在一定温度下,当液面上的 一种气体与溶液中所溶解的气体达到平衡时,该气体在溶液 中的浓度与其在液面上的平衡压力成正比,这就是亨利定律 若浓度的表示方法不同,亨利定律可表示为 PB:平衡时溶液中挥发物质的分压 xB:挥发溶质在溶剂中的摩尔分数 Kx:亨利系数,与 T,P,溶剂及溶质的性质有关 B p = B m m k m B p = B c c k c PB =KX xB