
泛地使用水制备各即溶液,在日常生活中,人们普遍地用水清流去 污,都是充分利用水的这一特性。世界大洋中的海水,就是水溶解 了许多物质的复杂的溶液。正因为海水溶解了多种物质,所以其性 质又与纯水大不相同。 .2.3水的密度变化有反常 “熟胀冷缩”是一般物体的性质,除水之外,其他液体也人都如 此。纯水在(3.985士0,005)℃(a,1968年国际实用摄氏温标)以 上时,密度随温度的降低而增大:等于该温度时,水的密度最人, a-(SM0W)=°=(999.975土0.003)kg·m-(UNESC0,Technic1 apers in marine science,45,1985),低了该温度时,密度随温皮的降 低反而减小,即所调“反常膨胀”。水冻结为冰后体积增大。密度减 小,可达916.7kg/m',因而冰总是浮在水上。进入岩石脉链的水, 结冰后反常膨张,会对周围产生很大的压力,甚至可达200MP以 上,足以将岩石胀裂。古代的劳动人民曾用此法切制岩石,至今还 有些地方仍在沿用这种腰价的方法。 水的密度的上述变化,是由水分子的缔合而造成的,温度低于 3.985℃时,有利于水分子缔合:冻结为冰时,这些水分子则全部缔 合成一个巨大的分子集合体一分子品体。功于其品格结构排列 松散,放密度减小。温度从0.℃升达3.985C以前,主要过程是 较大的筛合分子谬新离解为较小的缩合分子,因而体积收缩密度 增大。高于3.985C以后,由于水分子的热运动加强,导致体积膨 胀,所以密度又随温度升高而减小。这样,就使得纯水在(3.85 士0,005)C()时有最大的密度。最大密度的温度记为(max)或 ,因在本书中!又是时闻的符号,故记为(max)或。相应地, 也改1为0制
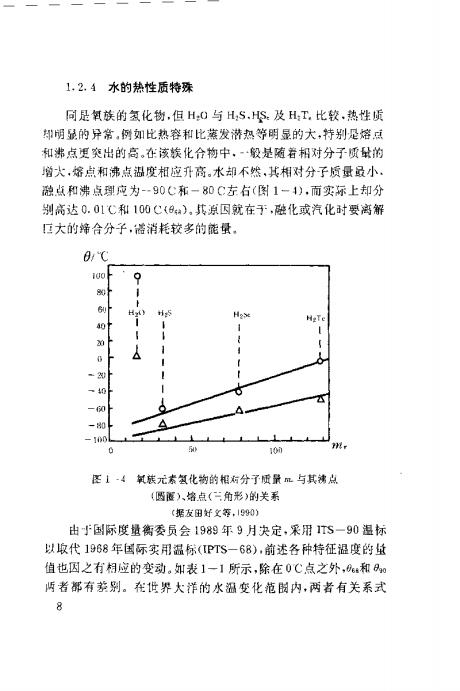
1,2.4水的热性质特殊 同是氧族的氢化物,但H:0与HS,HS:及H:T,比较,热性质 却明显的异常,例如比热容和比蒸发潜热等明显的大,特别是溶点 和湖点更突出的高。在该装化合物中,般是随着相对分子质量的 增大,熔点和沸点温度相应升高。术却不然,其相对分子质量最小 融点和沸点理应为-90C和一80C左右(图1一1),而实标上却分 别高达0.01℃和100C(9a),其原国就在于,融化或汽化时要离解 口大的筛合分子,诺消耗较多的能量, 0℃ 100 6 H 时5 H2* HgTe 40t 1 20 一40 一0 一0 -10 101 图1-4氧熊元素氢化物的相新分子质量m与其沸点 (圆偃)、培点(角彩)的关系 (据友田好文等,1590) 出5国际度量衡委员会1989年9月决定,采用1TS一90温标 以收代1988年国际实用温标(IPTS一68),前述各种特征福度的敏 值也因之行相应的变动。如表1一1所示,除在0C点之外,和 两者部有茅别。在世界大洋的水温变化范园内,两若有关系式 8

(Saunders P.M.,1990): 0▣=0,999760sa (1.2-1) 依Ts一90,水的冰点仍是0.010℃(),但沸点变为99,974℃ (0),而8(ma)变为(3.984士0.005)℃(0o). 表1一106和s的差值(据Saunders P.M,l980) a/℃ -10 0 10 20 30 40 (外a-a》/℃ 0.002 0.G00 -0.002 -0.005 -0.t07 -0.010 §1.3海水的盐度 世界上液态的纯水数量不多,自然存在的淡水也不纯净,其中 往往溶有其他物质。海水则更甚,它溶解了多种无机盐类、有机物 质和气体,而且含有悬浮物质,海水中的元素可达80多种溶解物 质中,尤以氯箫化钠含量最多,致使海水带有咸苦味。为了描述海水 含盐的浓度,】865年Forchhammer引用了“盐度(siinity)”一词。随 着海洋研究的逐步深人,发现海洋中的许多现象和过程,都与盐度 的分布和变化息息相关,从而对盐度的确切定义和精确测定提出 了更高的要求。许多海洋学家为此敝出了贡献,例如克努曾(: snM.H.C.)等在本世纪初对海水氯度和盐度定义的探讨-:, 定,在考克斯(CoxR.A.)等人研究基础上,60年代对盐度的再定 义以及1978年实用盐度标度(PS$78)的提出,就是最具代表程的 成果。根据联合国教科文组织(UNESCO)、国际海洋考察理事会 (1CES),海洋研究科学委员会(SCOR)和国际海洋物理科学协会( 1APS0)的联合通告,于1982年1月】日起采用1978年实用盐度 标度和1980年新的国际海水状态方程,从而取代了以前的方法、 公式和表格(UNESC0,1981a-d)

为了尽可能而有效使用历史的氢度及盐度资料,葡要介绍盐 度定义的演化以及新旧资料的转换方法,是很有必要的。 1.3.1盐度的首次定义 1902年在克努曾的领导下,提出了测定盐度的一种方法,据 此把海水盐度定义为:“1kg海水中的澳和碘全部以当量的氢置 换,碳酸盐全部转换成氯化物,有机物全部氧化之后,所得固体物 质的总克数”,单位是gk8,符号为光。 显然,按上述定义测定盐度,既繁杂我时又不便于海上操作。 为应用方便,遂根据采白北海,波罗的海,红海等的9个表层水样, 测定它们的氯度和盐度,基于海水组成恒定性规律,归纳出用氯度 方便地计算盐度的公式: S%6=0.030十1.8050C%6 (1,31) 式中氢度C%可以用AO,滴定法较快地测定。瓢度的定义也是 克努曾等于1902年提出的:1k5海水中以氯置换溴和碘后,氯离 子的总克数称为策度,单位8/kg,记为C%。后来发现,出于相对 原子质量的测定值的变化,会影响氯度的量值,因而1940年对氯 度重新定义:沉淀0.3285234kg海水中的全部卤素所需纯银的总 克数(中回大百科全书,987)。 1,3.2盐度的重新定义 依式(1.3一1)计算盐度的确方便,故…直延续使用到60年 代。但人们也发现了许多问题,例如当氧度为0时,盘度值大于0, 显然不合理:再者,公式建立的基础一一海水组成恒定性,本身就 不够格:而所用水样又以波罗的海的表层水居多,难以代表整个 世界大祥的们普遍规律。于是,上述1个国际组织发起,成立了海水 状态方程式联合小组,后改为“海弹用表与标准联合专家小组” (JP0IS),经多次讨论研究之后,为保持历史资料的统一性,将盐 10

度公式改为(Wooster et al,1969): S%=1.80655C1%, (1.32) 显见,当C%=19.355%:时,上二式计算的盐度值均为34.965%: 当氯度大于此值时,后者计算的盐度值稍大:在低盐时,二式计算 结果差别也大。 50年代以来,由于电导盐度计研究的不断发菠,不仅使盐度 测定方法简化,而且箱度大为提高考克斯等(CxR。A., 1967)对由大洋和不同海区不深于100m水层内采集的135个水 祥,准确地测定其氯度值,按上式计算盐度值,并且测定了电导比 R,得出盐度S%与电导比Rs有关系式: 8%=-0.08996+28.29720Rs+12.80832-10.67869 +5.986245-1.323115 (1.3-3) 式中Rs是在15℃和“-个标准大气压”(为忠实于原文,暂未按 NESC0,N0.45规定改为P.)①下水样与S=35.000%的标准海 水的电导率的比值。依此可使测盐精度达士0.003%。,而测定速度 快45倍。鉴于比,1969年JP0TS推荐该式为海水盐度新定义。 然而,从上述定义的由来可知,它既仍然依敕于氯度滴定,又以海 水组成恒定性为前提。应该指出,氯度的测定只与海水中的特定离 于相对应,而电导率的测定却与海水中的所有离子都有关,这显然 是其不足之处。再者,与此定义相匹配的国际海洋常用表(UN ESC0,1966),温度范围只包括(10~31)℃,即低于10℃时也不能 查算,所以仍有必要改进。 】.3.31978年实用盐度标度(the Practical Salinity Scale,1978 实用盐度标度窃底摆脱了氯度,而只依救于电导方法测定。然 ①恢UNCO,N0.45,185,-一个人'(”或“标在大气斤"均应改为101325P, 即p2=1D1325Ps 11