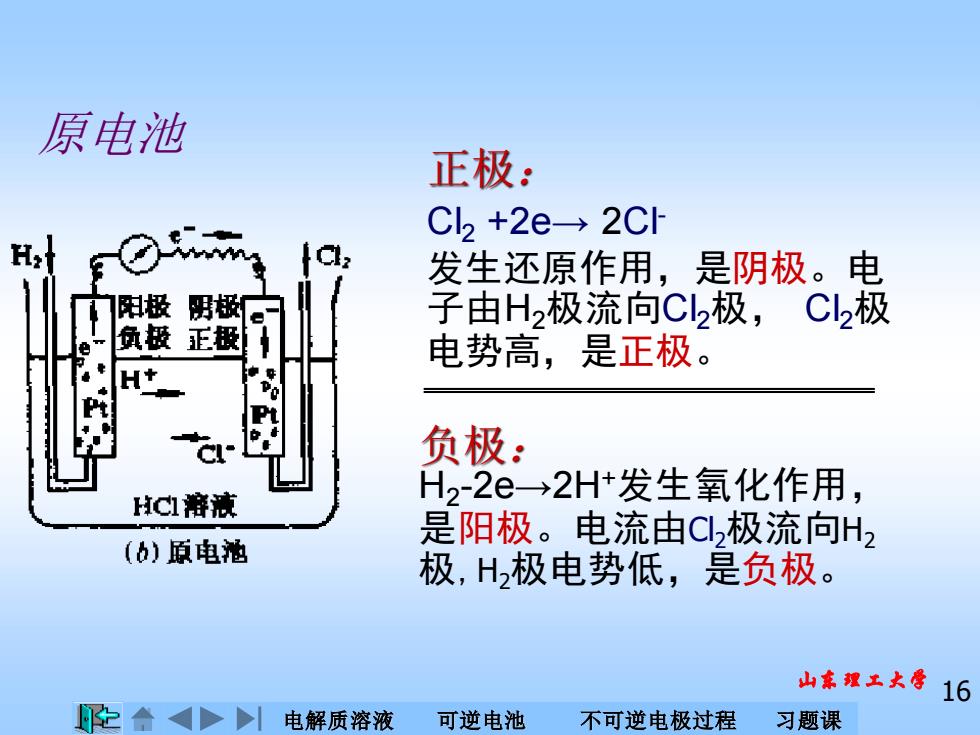
原电池 正极: C2+2e→2Cl H Cl: 发生还原作用,是阴极。电 阳极 极 子由H2极流向C2极,C2极 负极正极 电势高,是正极。 负极: HC溶液 H22e→2H+发生氧化作用, 是阳极。电流由C2极流向H2 (b)原电池 极,H2极电势低,是负极。 山东工大导16 合>电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 16 原电池 H2 -2e→2H+发生氧化作用, 是阳极。电流由Cl2极流向H2 极,H2极电势低,是负极。 负极: Cl2 +2e→ 2Cl- 发生还原作用,是阴极。电 子由H2极流向Cl2极, Cl2极 电势高,是正极。 正极:
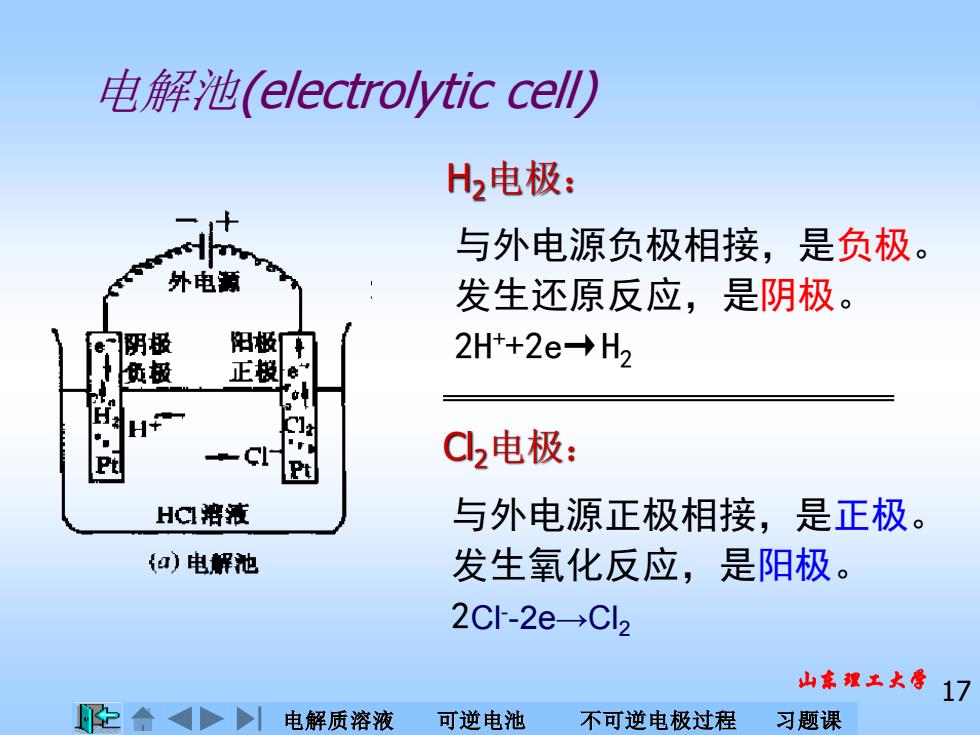
电解池(electrolytic cel) H2电极: 与外电源负极相接,是负极。 外电新 发生还原反应,是阴极。 阴极 阳极车 2Ht+2e→H2 负极 正极e H¥ 1 P C2电极: HC溶液 与外电源正极相接,是正极。 扣)电解池 发生氧化反应,是阳极。 2C-2e→Cl2 山东螺工大摩17 电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 17 电解池(electrolytic cell) 与外电源正极相接,是正极。 发生氧化反应,是阳极。 2Cl- -2e→Cl2 Cl2电极: 与外电源负极相接,是负极。 发生还原反应,是阴极。 2H++2e→H2 H2电极:

法拉第定律的文字表述 Faraday's Law 内容:当电流通过电解质溶液时,通过电极的电 量与发生电极反应的物质的质量成正比。 法拉第定律的意义 1.是电化学上最早的定量的基本定律,揭示了 通入的电量与析出物质之间的定量关系。 2.该定律在任何温度、任何压力下均可以使用。 3.该定律的使用没有什么限制条件。 山东理土大学18 陀合>1电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 18 法拉第定律的文字表述 Faraday’s Law 内容: 当电流通过电解质溶液时,通过电极的电 量与发生电极反应的物质的质量成正比。 ⒈ 是电化学上最早的定量的基本定律,揭示了 通入的电量与析出物质之间的定量关系。 ⒉ 该定律在任何温度、任何压力下均可以使用。 ⒊ 该定律的使用没有什么限制条件。 法拉第定律的意义

法拉第定律的数学表达式 M2++ze→M Az-ze->A 取电子的得失数为2,通入的电量为Q,则电极 上发生反应的物质的量n为: 或 O=nzF 电极上发生反应的物质的质量m为: m=nM=OM 山嘉理工大号19 电解质溶液 可逆电池 不可逆电极过程习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 19 法拉第定律的数学表达式 取电子的得失数为 z,通入的电量为 Q,则电极 上发生反应的物质的量 n 为: 电极上发生反应的物质的质量 m 为: z- M e M A e A z z z + − + − − + → − → Q m nM M zF = = Q n zF = 或 Q nzF =

法拉第常数 法拉第常数在数值上等于1mol元电荷的电量。 已知元电荷电量为1.6022×10-19C FLe =6.022×1023mol1×1.6022×10-19C =96484.6Cmo-1 ≈96500Cmol-1 山东锦工大学20 陀合4D1 电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 20 法拉第常数 F=L·e 法拉第常数在数值上等于1 mol元电荷的电量。 已知元电荷电量为 19 1.6022 10 C − =6.022×1023 mol-1×1.6022×10-19 C =96484.6 C·mol-1 ≈96500 C·mol-1