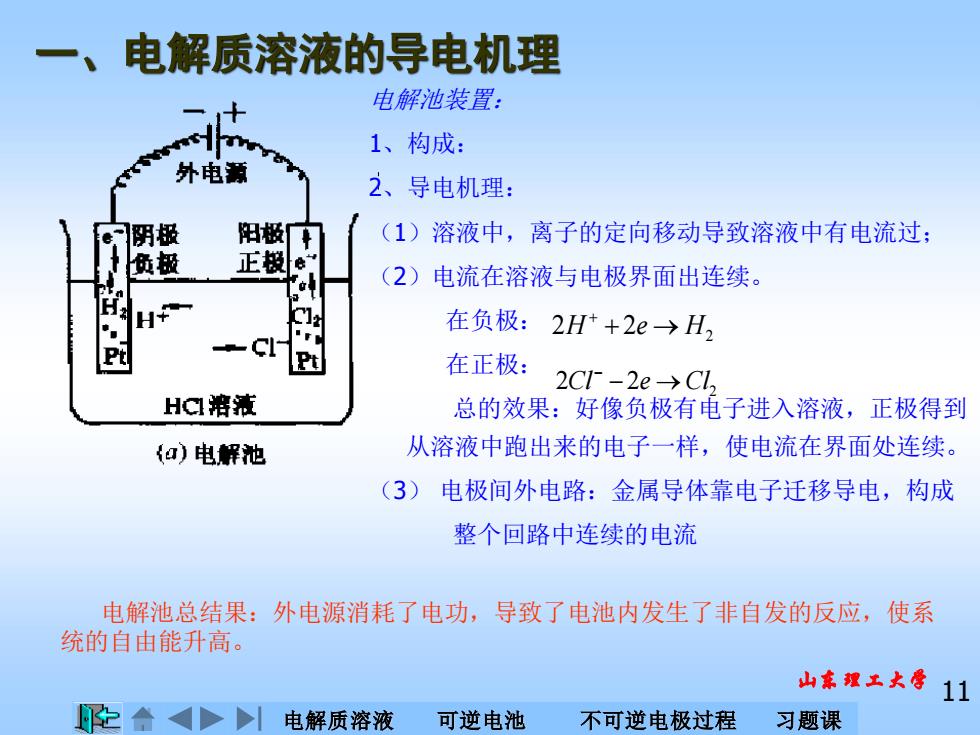
电解质溶液的导电机理 电解池装置: 1、构成: 外电新 2、导电机理: 阴极 阳极车 (1)溶液中,离子的定向移动导致溶液中有电流过: 极 正极e: (2)电流在溶液与电极界面出连续。 在负极:2H++2e→H2 Pt 在正极: 2C1-2e→C1, HC溶液 总的效果:好像负极有电子进入溶液,正极得到 a)电解池 从溶液中跑出来的电子一样,使电流在界面处连续。 (3)电极间外电路:金属导体靠电子迁移导电,构成 整个回路中连续的电流 电解池总结果:外电源消耗了电功,导致了电池内发生了非自发的反应,使系 统的自由能升高。 山东理工大摩11 电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 11 电解池装置: 1、构成: 2、导电机理: (1)溶液中,离子的定向移动导致溶液中有电流过; (2)电流在溶液与电极界面出连续。 在负极: 在正极: 总的效果:好像负极有电子进入溶液,正极得到 从溶液中跑出来的电子一样,使电流在界面处连续。 (3) 电极间外电路:金属导体靠电子迁移导电,构成 整个回路中连续的电流 2 2H + 2e → H + 2 2Cl − 2e →Cl − 电解池总结果:外电源消耗了电功,导致了电池内发生了非自发的反应,使系 统的自由能升高。 一、电解质溶液的导电机理

原电池装置: H C1:1、构成: 阳极因极 2、导电机理: 负极正极 (1)界面上自发反应: 在H2电极上H2-2e→2H H+进入溶液, 电子流在电极上,电极电势降低,为负极。 在C2电极上,CL,+2e→2CI C2夺取电极 HC溶液 上的电子,发生还原反应,电极电势升高。两电极 ()原电汹 间产生电极差。 (2)在溶液中:离子迁移产生电流。 原电池总结果:发生自发反应,△G<0,原电池自由能下降,转化为对外所作 的电功,若电池反应是可逆的,-△G=W=QE 山东理土大骨 12 合4>1 电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 12 原电池装置: 1、构成: 2、导电机理: (1)界面上自发反应: 在 H2电极上, H+进入溶液, 电子流在电极上,电极电势降低,为负极。 在Cl2电极上, Cl2 夺取电极 上的电子,发生还原反应,电极电势升高。两电极 间产生电极差。 (2)在溶液中:离子迁移产生电流。 → + H2 − 2e 2H → − Cl + 2e 2Cl 2 原电池总结果:发生自发反应,△G<0,原电池自由能下降,转化为对外所作 的电功,若电池反应是可逆的, -△G=W=QE

结论: 1借助电化学装置可以实现电能与化学能的相互转化 2电解质溶液的导电机理 ①正负离子定向迁移; ②界面上分别发生氧化还原反应,电荷转移; 结果实现了化学能和电能之间的转换。 3电极命名法: 正极(电势高) 负极(电势低) 山理土大号13 陀合41 电解质溶液 可逆电池 不可逆电极过程习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 13 结论: 1借助电化学装置可以实现电能与化学能的相互转化 2电解质溶液的导电机理 ①正负离子定向迁移; ②界面上分别发生氧化还原反应,电荷转移; 结果实现了化学能和电能之间的转换。 3 电极命名法: 正极(电势高) 负极(电势低)

正极: 电势高的极称为正极,电流从正极 流向负极。 负极: 电势低的极称为负极,电子从负极 流向正极。 山东望土大骨 14 陀合D1 电解质溶液 可逆电池 不可逆电极过程 习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 14 电势低的极称为负极,电子从负极 流向正极。 负极: 电势高的极称为正极,电流从正极 流向负极。 正极:

阴极、阳极 阴极: 发生还原作用的极称为阴极 (Cathode) 阳极: 发生氧化作用的极称为阳极 (Anode) 山意理工大摩15 电解质溶液 可逆电池 不可逆电极过程习题课
电解质溶液 可逆电池 不可逆电极过程 习题课 山东理工大学 15 阴极、阳极 阴极: 发生还原作用的极称为阴极 (Cathode) 阳极: 发生氧化作用的极称为阳极 (Anode)